1、选择题 有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
A.HF
B.H3O+
C.NaH
D.H2O2
参考答案:C
本题解析:ⅦA族的元素在化合物中一般显示-1价,NaH中的H即显示-1价。
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。
本题难度:一般
2、选择题 A、B、C三种短周期元素在周期表中位置如下图所示,B位于ⅥA族.下列叙述错误的是(?)

A.原子半径大小顺序为B>A>C
B.C的最高价氧化物的水化物酸性最强
C.BO2具有漂白性
D.A的氢化物水溶液呈碱性
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列说法正确的是
A.酸性氧化物都是非金属氧化物
B.非金属氧化物都是酸性氧化物
C.金属氧化物都是碱性氧化物
D.碱性氧化物都是金属氧化物
参考答案:D
本题解析:试题分析:本题是对基本的考查。
选项A、酸性氧化物并不一定都是非金属氧化物,还有某些过渡金属元素的高价氧化物(如CrO3)也是酸性氧化物,但它是金属氧化物;
选项B、并不是所有的非金属氧化物都是酸性氧化物,如CO;
选项C、说法过于绝对,Fe3O4是金属氧化物,但不是碱性氧化物。
考点:物质的分类
点评:本题是对基本概念以及其辨析的考查。
①酸性氧化物:能与水作用成酸或与碱作用成盐的氧化物。一般是非金属元素的氧化物。
注意:酸性氧化物并不一定都是非金属氧化物;
非金属氧化物并不都是酸性氧化物;
②碱性氧化物:能与水作用成碱或与酸作用成盐的氧化物。一般是金属元素的氧化物。
注意:金属氧化物并不都是碱性氧化物;
碱性氧化物一定是金属氧化物。
本题难度:一般
4、选择题 下列递变规律正确的是:
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.P、S、Cl最高正价依次升高
C.HCl、HBr、HI的稳定性依次增强
D.锂、钠、钾的金属性依次增强
参考答案:BD
本题解析:A.元素的非金属性Cl>S> P。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。因此酸HClO4、H2SO4、H3PO4的酸性依次减弱。错误。B.P、S、Cl最外层电子数分别为5、6、7.元素的最高正价等于其元素原子的最外层电子数。所以P、S、Cl最高正价依次升高。正确。C.Cl、Br、I的非金属性逐渐减弱。元素的非金属性越强,其氢化物的稳定性就越强。所以HCl、HBr、HI的稳定性依次减弱。错误。D.锂、钠、钾是同一主族的元素,从上到下元素的原子半径逐渐增大,原子失去电子的能力逐渐增强,因此元素的金属性依次增强。正确。
本题难度:一般
5、选择题 短周期元素X、Y、Z、W在元素周期表中的相对位置如图6所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
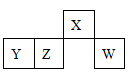
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液一定显酸性
C.最简单气态氢化物的热稳定性:Z>W
D.X与氢元素组成的离子化合物XH5与水反应可产生两种气体
参考答案:D
本题解析:由题干信息可知W是硫,X是氮,Y是铝,Z是硅。A中同一周期从左到右原子半径依次是减小的,一般而言,原子的电子层数越多原子半径就越大,正确顺序为rY> rZ>rW>rX,错误;B是铝元素,其铝离子的盐溶液显酸性,其偏铝酸根离子的盐溶液显碱性,错误;C同一周期从到右非金属性增强,最简单气态氢化物的热稳定性也相应增强,应该是W>Z,错误;D 中XH5实际上是氢化铵NH4H,与水反应后生成氨气和氢气,正确;
本题难度:一般