1、选择题 一集气瓶中气体呈红棕色,加入适量水后,盖上瓶盖振荡,得到橙色溶液,气体的红棕色消失,再打开瓶盖后,瓶中又呈红棕色,则原瓶中混合气体可能是(?)?
A.NO2.N2.Br2
B.N2.O2.Br2
C.NO.N2.Br2
D.NO2.N2.O2
参考答案:AC
本题解析:溴气为红棕色溶于水得到橙色溶液,二氧化氮是红棕色,加水后得到橙色溶液说明原气体中一定有溴气,D选项排除;二氧化氮与水反应生成无色的一氧化氮,当一氧化氮遇到氧气时又会与氧气反应生成二氧化氮,加水后红棕色消失,打开瓶盖后又变为红棕色说明原混合气体中存在二氧化氮或一氧化氮。答案选AC
本题难度:简单
2、选择题 下列物质的分离方法不正确的是( )
A.用酒精萃取碘水中的碘
B.用蒸馏的方法将自来水 91eXaM.org制成蒸馏水
C.用淘洗的方法从沙里淘金
D.用过滤的方法除去食盐水中的泥沙
参考答案:A.萃取剂应与水互不相溶,但酒精和水混溶,不能用作萃取剂,故A错误;
B.水易挥发,可用蒸馏的方法制取,故B正确;
C.金子的密度比较大,在沙子的底部,可用淘洗的方法从沙里淘金,故C正确;
D.泥沙不溶于水,可用过滤的方法分离,故D正确.
故选A.
本题解析:
本题难度:简单
3、实验题 某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。【已知完全沉淀的pH:Ca(OH)2:pH ≥ 13;Al(OH)3:pH ≥ 5.5;Fe(OH)3:pH ≥ 4.1】
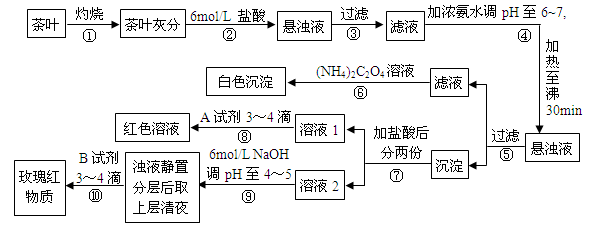
下列说法不正确的是
A.步骤②加入6mol/L盐酸的主要目的是为了将茶叶灰分中的钙、铁、铝难溶性化合物转化为可溶性氯化物
B.步骤⑤所得滤液中溶质的主要成分为:CaCl2、NH3·H2O
C.步骤⑥可以检出钙元素存在,离子反应方程式为Ca2++C2O42- = CaC2O4↓
D.步骤⑧中A试剂为KSCN溶液,离子反应方程式为Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
参考答案:B
本题解析:根据题意知,茶叶灼烧得到灰分经步骤②:加入6mol/L盐酸,将茶叶灰分中的钙、铁、铝难溶性化合物转化为可溶性氯化物;经步骤④:在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,经⑤过滤后所得滤液中含CaCl2、NH4Cl,步骤⑥中发生反应是草酸铵和钙离子形成草酸钙沉淀的反应;⑧是加入硫氰酸钾溶液出现血红色证明含有铁离子;步骤⑨是调节溶液PH值4-5,结合离子沉淀PH范围分析作用是把铁离子完全沉淀;步骤⑩是检验铝元素存在的操作。A、步骤②加入6mol/L盐酸的主要目的是为了将茶叶灰分中的钙、铁、铝难溶性化合物转化为可溶性氯化物,正确;B、步骤⑤所得滤液中溶质的主要成分为:CaCl2、NH4Cl,错误;C、步骤⑥可以检出钙元素存在,离子反应方程式为Ca2++C2O42- = CaC2O4↓,正确;D、步骤⑧中A试剂为KSCN溶液,离子反应方程式为Fe3++3SCN- Fe(SCN)3,正确。
Fe(SCN)3,正确。
本题难度:一般
4、选择题 除去括号内杂质所用试剂和方法不正确的是( )
A.Fe?(Al)--氢氧化钠溶液,过滤
B.KNO3(NaCl)--结晶
C.水(NaCl)--蒸馏
D.淀粉(泥沙)--渗析
参考答案:A、铁中混有的铝可以和氢氧化钠反应生成偏铝酸钠和氢气,铁不反应,反应后过滤得到铁,故A正确;
B、硝酸钾溶解度随温度变化大,氯化钠溶解度随温度变化不大,可以通过结晶法除去硝酸钾中的氯化钠,故B正确;
C、食盐水中水的沸点低,利用蒸馏法使水和NaCl分离,从而除去水中的氯化钠,故C正确;
D、淀粉溶液是胶体,泥沙是浊液,渗析是利用半透膜只允许溶液通过,淀粉和泥沙都不能通过半透膜,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 设阿伏加德罗常数为NA.则下列说法正确的是
A.常温常压下,18.0g重水(D2O)中所含的电子数为10NA
B.1cm3铁所含的铁原子数是ρ?NA/56(ρ是铁的密度,单位为g?cm-3)
C.2.24LCO2与足量的Na2O2反应,Na2O2转移的电子总数一定为0.1NA
D.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
参考答案:B
本题解析:分析:A、质量换算物质的量,结合分子式计算电子数分析判断;
B、依据密度和体积计算质量换算物质的量计算分析;
C、依据气体摩尔体积的条件应用分析判断;
D、依据常温下铝在浓硫酸中钝化分析判断;
解答:A、18.0g重水(D2O)物质的量=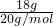 =0.9mol,所含的电子数=0.9mol×(1×2+8)×NA=9NA,故A错误;
=0.9mol,所含的电子数=0.9mol×(1×2+8)×NA=9NA,故A错误;
B、1cm3铁的物质的量=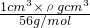 =
= mol,所含的铁原子数是ρ?NA/56,故B正确;
mol,所含的铁原子数是ρ?NA/56,故B正确;
C、温度压强不知,2.24LCO2物质的量不确定是0.1mol,则转移的电子数不能确定,故C错误;
D、常温下,2.7g铝片投入足量的浓硫酸中发生钝化现象,不再继续反应,故D错误;
故B.
点评:本题考查了阿伏伽德罗常数的条件应用,主要是质量换算物质的量来计算微粒数,气体摩尔体积的条件应用,关键是常温下铝在浓硫酸中钝化.
本题难度:一般