1、选择题 下列物质中,含有非极性共价键的化合物是:
A.Na2O2
B.NaCl
C.NaOH
D.Br2
参考答案:A
本题解析:A中的Na2O2,钠离子与过氧根之间是离子键,而过氧根离子内部两个氧原子间是非极性共价键.
B选项, NaCl中只有离子键.
C选项,NaOH中钠离子与氢氧根离子之间是离子键,而氢氧元素间是极性共价键.
D选项, Br2是同种元素构成的双原子单质分子,含非极性共价键.
本题难度:简单
2、选择题 六氟化硫分子,性质稳定,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是
A.SF6易燃烧生成二氧化硫
B.SF6中各原子均达到 8 电子稳定结构
C.价层电子对数为6,正六面体结构
D.SF6是由极性键构成的非极性分子
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下列物质中,以极性共价键结合的是
[? ]
A.MgO
B.NaCl
C.H2
D.H2O
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列各组的几种分子中所有原子都可能处于同一平面的是
A.CH4、CS2、BF3
B.CO2、H2O、NH3
C.C2H4、C2H2、C6H6
D.CCl4、BeCl2、PH3
参考答案:C
本题解析:A项中的CH4,C是sp3杂化,正四面体构型,所有原子不可能处于同一平面,B项中的NH3,N是sp3杂化,三角锥构型,所有原子不可能处于同一平面,D项中的CCl4,C是C是sp3杂化,正四面体构型,所有原子不可能处于同一平面。答案选C。
点评:sp3杂化正四面体构型,sp2杂化平面三角形,sp杂化直线型。
本题难度:一般
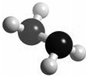
5、选择题 肼(N2H4)分子中所示原子均达到稀有气体原子的稳定结构,它的沸点高达l13℃,燃烧热为642kJ?mol-1,肼与氧气及氢氧化钾溶液还可构成燃电池.已知肼的球棍模型如图所示,下列有关说法正确的是( )
A.肼是由极性键和非极性键构成的非极性分子
B.肼沸点高达l13℃,可推测肼分子间可形成氢键
C.肼燃烧的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-642?kJ?mol-1
D.肼-氧气燃料电池,负极的电极反应为:O2+2H2O+4e-=4OH-