|
|
|
高中化学知识点讲解《键参数——键能、键长与键角》高频考点巩固(2017年模拟版)(十)
2017-11-05 23:34:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
参考答案:(16分)(1)①1s22s22p63s33p63d5或 [Ar]3d5?(2分)?② 4∶3?(1分)
③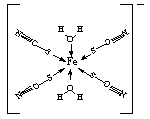 ( 1分)?④KMgF3(2分其它合理答案也可给分) ( 1分)?④KMgF3(2分其它合理答案也可给分)
(2)①10-29 mol·L-1(2分)?②4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1808kJ·mol-1(2分)
(3)①BD?(2分,有错即为0分,少一个扣1分)
②Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑?(2分,不写条件扣1分)?③13(2分) Mg(OH)2↓+H2↑+Cl2↑?(2分,不写条件扣1分)?③13(2分)
本题解析:(1)①铁的原子序数是26,则根据构造原理可知基态Fe3+的核外电子排布式为1s22s22p63s33p63d5或 [Ar]3d5。
②已知(CN)2是直线型分子,并有对称性,因此该化合物的结构式应该是C≡N-C≡N。由于单键都是σ键,三键是由1个σ键和2个π键构成的,所以(CN)2中π键和σ键的个数比为4:3。
③SCN-与Fe3+形成的种配合物中铁原子含有空轨道,S和O原子含有孤对电子,从而形成配位健。则该配合物中的配位键(以箭头表示)为 。 。
④根据晶胞结构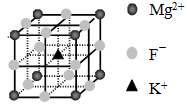 可知,镁离子在顶点处、氟离子在棱上、钾离子在体心处,所以根据均摊法可知,晶胞中含有的Mg2+、F-、K+个数分别是8× 可知,镁离子在顶点处、氟离子在棱上、钾离子在体心处,所以根据均摊法可知,晶胞中含有的Mg2+、F-、K+个数分别是8×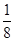 =1、12× =1、12×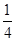 =3、1,所以该物质的化学式是KMgF3。 =3、1,所以该物质的化学式是KMgF3。
(2)①2.3g钠的物质的量=2.3g÷23g/mol=0.1mol,则根据原子守恒可知NaNH2的物质的量也是0.1mol,因此NH2-的浓度是0.1mol/L。所以根据离子积常数为l.0×l0-30可知,溶液中NH4+的浓度=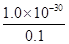 =1×10-29 mol/L。 =1×10-29 mol/L。
②已知:I、N2(g)+O2(g)=2NO(g)?△H=180kJ·mol-l,Ⅱ、4NH3(g)+5O2(g)=4NO(g)+6H2O(g)?△H=-908 kJ·mol-l,则根据盖斯定律可知,Ⅱ-I×5即得到反应4NH3(g)+6NO(g)=5N2(g)+6H2O(g),所以该反应的反应热△H=-908 kJ·mol-l-180kJ·mol-l×5=-1808kJ·mol-1,则热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(g)?△H=-1808kJ·mol-1。
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式
(3)①A、通电一段时间后乙装置左侧电极质量增加,这说明该电极是阴极,溶液中的阳离子铜离子放电析出铜,电极反应式是Cu2++2e-=Cu,A正确;B、X是电源的负极,Y是正极,则丙装置中银电极是阳极,铜电极是阴极,所以该装置是电镀池,即在铜上镀银,溶液的pH不变,B不正确;C、甲装置是电解氯化钾溶液,生成物是氢氧化钾、氢气和氯气,所以向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态,C正确;D、电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则根据氧原子守恒可知,电解中生成氧气的物质的量是0.1mol,所以电路中通过的电子为0.1mol×4=0.4mol,D不正确,答案选BD。
②若将甲中溶液换成MgCl2,则阴极是氢离子放电,阳极是氯离子放电,生成物还有氢氧化镁白色沉淀,则电解总反应的离子方程式为Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑。 Mg(OH)2↓+H2↑+Cl2↑。
③若Cu电极上质量增加2.16 g, 即析出银的质量是2.16g,物质的量=2.16g÷108g/mol=0.02mol。根据电子得失守恒可知,甲装置也应该转移0.02mol电子,所以反应中生成0.02mol氢氧化钠,氢氧化钠的物质的量浓度=0.02mol÷0.2L=0.1mol/L,所以溶液的pH=13。
本题难度:困难
2、选择题 分子有极性分子和非极性分子之分。下列对极性分子和非极性分子的认识不正确的是
[? ]
A.只含非极性键的分子一定是非极性分子
B.含有极性键的分子一定是极性分子
C.非极性分子可能含有非极性键,也可能含有极性键,或同时含有极性键和非极性键
D.极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列物质的化学式及其对应的名称均正确的是( )
A.(NH4)2SO4--硫酸氨
B.KAl(SO4)2--明矾
C.S--硫磺
D.FeS2--硫化亚铁
参考答案:A.(NH4)2SO4的名称为硫酸铵,故A错误;
B.明矾为KAl(SO4)2?12H2O,故B错误;
C.S单质俗称硫磺,故C正确;
D.FeS2为二硫化亚铁,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 下列物质中属于离子化合物的是( )
A.苛性钾
B.碘化氢
C.硫酸
D.醋酸
参考答案:A
本题解析:
本题难度:一般
5、选择题 如图为周期表中短周期的一部分,若A原子的最外电子层上有5个电子,则下列说法中不正确的是( )
A.D的单质可跟B的氢化物的水溶液反应
B.A的高价氧化物对应水化物比B的高价氧化物对应水化物的酸性弱
C.B的氢化物比C的氢化物稳定
D.原子半径A>B>C
|

参考答案:A原子的最外电子层上有5个电子,根据短周期元素在周期表中的位置可知,A为P元素,B为S元素,C为Cl元素,D为O元素,则
A.D的单质为O2,B的氢化物为H2S,二者可发生:2H2S+O2=2S+2H2O,故A正确;
B.根据同周期元素从左到右元素的非金属性逐渐减弱,对应的高价氧化物对应水化物逐渐减弱可知,A的高价氧化物对应水化物比B的高价氧化物对应水化物的酸性弱,故B正确;
C.同周期元素从左到右元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,则B的氢化物不如C的氢化物稳定,故C错误;
D.同周期元素从左到右原子半径逐渐减小,则原子半径A>B>C,故D正确.
故选C.
本题解析:
本题难度:简单
