1、填空题 (13分)X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素。
Q
| I1
| I2
| I3
| I4
| I5
| …
|
电离能(kJ/mol)
| 496
| 4562
| 6912
| 9543
| 13353
| …
|
回答下列有关问题:
(1)W原子的外围电子排布图为_______________________________。
(2)化合物Q2W2的电子式______________,化合物XYZ的结构式________________。
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是?(写分子式),原因是?。
(4)RW3分子中的键角___________,RW32-分子的立体构型是_______________形。
(5)Y、W、Q三种元素所形成的常见化合物的晶体类型为?,YW2中的化学键类型为?共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有?(要求写一种即可)。
参考答案:(1)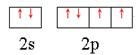 (2分)(2)
(2分)(2)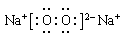 (2分)
(2分)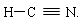 (1分)
(1分)
(3)SO2(1分)? SO2与水均为非极性分子,相似相溶(2分)
(4)120° (1分)三角锥(1分)(5)离子晶体(1分)?极性(1分)? N2(1分)
本题解析:Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,这说明X是氢元素,Y是碳元素,Z是氮元素,W是氧元素。W与R是同族元素,所以R是硫元素。根据Q的电离能可知,第二电离能远大于第一电离能,所以Q是钠元素。
(1)W原子的外围电子排布图为
 (2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为
(2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为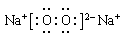 。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C? N.。
。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C? N.。
(3)CO2是非极性分子,SO2是极性分子,根据相似相溶原理可知,SO2易溶在极性溶剂水中。
(3)SO3分子中硫原子没有孤对电子,所以是平面三角形结构,键角是120℃的。SO32-中中心原子硫原子含有的孤对电子是(6+2-2×3)÷2=1,所以分子的立体构型是三角锥。
(5)C、O、Na三种元素形成的常见化合物是碳酸钠,属于离子晶体。CO2是共价化合物,含有风景线。电子数和原子数分别都相等的是等电子体,所以和CO互为等电子体且含有N原子的是氮气。
本题难度:一般
2、选择题 下列递变情况中不正确的是(? )
A.钠、镁、铝原子的最外层电子数依次增多
B.硅、磷、硫、氯元素的最高正化合价依次升高
C.碳、氮、氧、氟的原子半径依次增大
D.锂、钠、钾、铷的金属性依次增强
参考答案:C
本题解析:钠、镁、铝原子的最外层电子数依次为1、2、3,故钠、镁、铝原子的最外层电子数依次增多,所以A正确,不能选;硅、磷、硫、氯元素的最高正化合价依次为+4、+5、+6、+7,所以硅、磷、硫、氯元素的最高正化合价依次升高,故B正确,不能选;碳、氮、氧、氟的原子半径依次减小,故C错误,为本题的答案;锂、钠、钾、铷的金属性依次增强,故D正确。
点评:本题考查了元素周期表、元素周期律,该考点是高考考查的重点和难点,本题难度适中。
本题难度:一般
3、选择题 下列基态原子或离子的电子排布式错误的是 ?
A.Ca: 1s22s22p63s23p64s2
B.Mg2+: 1s22s22p6
C.F—: 1s22s22p5
D.Br: 1s22s22p63s23p63d104s24p5
参考答案:C
本题解析:根据构造原理可知 ,选项C是错误的,应该是1s22s22p6,其余选项都是正确的,答案选C。
点评:该题是高考中的常见考点和题型,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是记住构造原理,然后灵活运用即可。
本题难度:一般
4、选择题 已知X.Y元素同周期,且电负性X>Y,下列说法正确的是
A.最 高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
B.在同一周期中X位于Y的左面
C.Y的气态氢化物的稳定性大于X的气态氢化物的稳定性
D.X与Y形成的化合物中,X显负价,Y显正价
参考答案:D
本题解析:非金属性越强,电负性越大。同周期自左向右非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,电负性X>Y,所以非金属性是X>Y,因此X的原子序数大于Y的,X位于Y的右侧,氢化物的稳定性是X>Y,所以选项ABC都是错误的,正确的答案选D。
本题难度:一般
5、填空题 (9分)下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
|
3
| ③
| ④
| ⑤
| ⑥
| ?
| ⑦
| ⑧
| ⑨
|
4
| ⑩
| (11)
| ?
| ?
| ?
| ?
| (12)
| ?
|
(1)写出下列元素的元素符号:①?②?(11)?
(2)在这些元素中,最活泼的金属元素是?,最活泼的非金属元素是?,最不活泼的元素是?。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是?,碱性最强的是?,呈两性的氢氧化物是?。
参考答案:(1)① N?②? F? (11) Ca?(2)? K?, F?, Ar?。
(3)? HClO4?,? KOH?,? Al(OH)3?。
本题解析:略
本题难度:简单