1、填空题 银锌电池广泛用作各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。电池反应是:Ag2O+Zn+H2O="2Ag" +Zn(OH)2,根据上述判断:
(1)原电池的正极是__________,负极是__________。
(2)原电池电极反应式为:负极_______________,正极______________。
(3)工作时原电池负极附近溶液的pH__________ (填“增大”、“不变”、“减小”)。
参考答案:(5分)(1)Ag2O,? Zn。
(2)Zn+ 2OH--2e-=Zn(OH)2;Ag2O+H2O+2e-=2Ag+ 2OH-。?(3)减小
本题解析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,锌失去电子,作负极。氧化银得到电子,做正极。
(2)负极锌失去电子,电极反应式是Zn+ 2OH--2e-=Zn(OH)2。正极氧化银得到电子,电极反应式是Ag2O+H2O+2e-=2Ag+ 2OH-。
(3)根据负极电极反应式可知,工作时原电池负极消耗OH-,所以附近溶液的pH减小。
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固,难度不大。该题的关键是明确原电池的工作原理,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
2、选择题 用惰性电极分别电解下列物质的水溶液一段时间后,溶液的pH会升高的是
A.Ba(NO3)2
B.CuSO4
C.HNO3
D.NaOH
参考答案:D
本题解析:考查电极产物的判断。惰性电极电解硝酸钡、氢氧化钠和硝酸得失相当于电解水,所以选项A中pH不变;选项C中pH降低;选项D中pH增大;而电解硫酸铜,生成物是铜、氧气和硫酸,所以pH降低,答案选D。
本题难度:简单
3、选择题 如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是(?)

A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
参考答案:B
本题解析:根据装置可知,二者均构成原电池。由于金属性是锌>铁>铜,所以a中铁是负极失去电子,铜是正极,发生还原反应。由于溶液显中性,所以发生铁的吸氧腐蚀;b中铝是负极,失去电子,铁是正极,发生还原反应,也是发生吸氧腐蚀,只不过铁被保护,答案选B。
点评:金属腐蚀的本质是金属失去电子被氧化的过程,它又分为化学腐蚀和电化学腐蚀两种,其中以电化学腐蚀为主,而电化学腐蚀又可以分为析氢腐蚀和吸氧腐蚀两种,金属腐蚀大部分是吸氧腐蚀。金属的防护也主要是依据电化学原料,主要分为牺牲阳极的阴极保护法和外接电源的阳极保护法。
本题难度:一般
4、选择题 下列各个装置中能组成原电池的是
[? ]
A.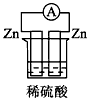
B.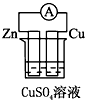
C.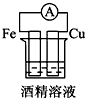
D.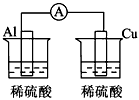
参考答案:D
本题解析:
本题难度:简单
5、填空题 铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路板的离子方程式____________________。
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极,并写出电极反应式。 负极反应:____________________; 正极反应:____________________。

参考答案:(1)2Fe3++Cu==Cu2++2Fe2+
(2)Cu-2e-==Cu2+;2Fe3++2e-==2Fe2+;原电池图:“略”
本题解析:
本题难度:一般