1、简答题 有人设计以Pt和Zn为电极材料,埋入人体作某种心脏起搏器的能源。它依靠人体内体液中含有一定物质的量浓度的溶解氧、H+和Zn2+进行工作。试写出两极反应的方程式。
2、计算题 合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 | 甲
| 乙
| 丙
|
反应物投入量
| 3 mol H2、2 mol N2
| 6 mol H2、4mol N2
| 2 mol NH3
|
达到平衡的时间/min
|
| 5
| 8
|
平衡时N2的浓度/mol·L-1
| c1
| 1.5
|
|
NH3的体积分数
| ω1
|
| ω3
|
混合气体密度/g·L-1
| ρ1
| ρ2
|
|
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
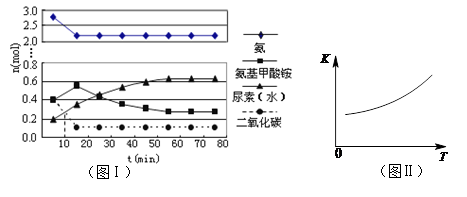
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H ="a" kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2="bkJ·" kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H=" c" kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。

3、填空题 (6分)从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现反应:
2FeCl3+Cu=2FeCl2+CuCl2
负极为 ,电极反应方程式为 ,
正极应选 ,电极反应方程式为 。
4、选择题 (08宝鸡质量检测,12)下列装置中发生的总反应为2AL+6H+=2AL3++3H2↑的是(铝条表面的氧化膜均已除去):
 ?
?
5、填空题 如图所示装置:
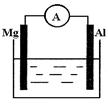
(1)若烧杯中溶液为稀硫酸,则观察到的现象为?。
两极反应式为:正极?;
负极??,该装置将?能转化为?能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为?,
总反应方程式为??。