1、选择题 已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是(?)
A.原子半径 A>B>D>C
B.原子序数 d>c>b>a
C.离子半径 C>D>B>A
D.单质的还原性 A>B>D>C
参考答案:C
本题解析:四元素在周期表中相对位置如图:

本题难度:一般
2、选择题 依据元素周期表及元素周期律,下列推断正确的是
A.同主族元素从上到下,单质的熔点逐渐降低
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
参考答案:B
本题解析:同主族元素从上到下,单质的熔点有的逐渐降低,例如第IA,有的逐渐升高,例如第Ⅶ
A。同主族元素自上而下非金属性逐渐减弱,所以氢化物的稳定性逐渐减弱。若M+和R2-的核外
电子层结构相同,则M是金属,R是非金属,所以原子序数一定是M大于R。所以正确的答案
是B。
本题难度:一般
3、填空题 (10分)已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元 素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
1.A原子的结构示意图为__________;A元素在周期表中位置为_____________________。
2.写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式_______________________________________。
3.A和C形成的化合物的电子式为_____________,该化合物的水溶液呈__________性(填“酸”或“碱”)。
参考答案:1. 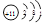 ;第三周期IA族? 2.Al2O3+2OH-→2AlO2-+H2O
;第三周期IA族? 2.Al2O3+2OH-→2AlO2-+H2O
3.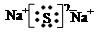 ;碱
;碱
本题解析:略
本题难度:一般
4、填空题 (12分)
已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
小题1:请写出B、D元素的名称:B?,D?
小题2:画出C元素的离子结构示意图?
小题3:写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
?
小题4:A、B、C三种元素形成的化合物为?,?所含的化学键类型为?
参考答案:
小题1:氧、铝?
小题1:
小题3:2Al+2OH-+2H2O=2AlO2-+3H2↑
小题4:NaOH?离子键和极性键
本题解析:考查原子核外电子的排布规律和元素周期表的结构以及元素周期律的应用。A元素原子形成的离子核外电子数为零,则A是H。E的单质为黄色晶体,易溶于二硫化碳,则E是S。B与E同主族,则B是O。C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,说明一定含有铝元素。根据原子序数大小可知D是Al,则C是Na。H、O和Na形成的化合物是NaOH,属于离子化合物,含有离子键和极性键。
本题难度:一般
5、选择题 某些建筑材料含有放射性元素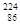 Rn(氡),会对人体产生一定危害。该原子的中子数和质子数之差是
Rn(氡),会对人体产生一定危害。该原子的中子数和质子数之差是
A.52
B.138
C.86
D.224
参考答案:A
本题解析: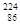 Rn质子数是86,中子数是224-86=138.所以该原子的中子数和质子数之差是138-86=52.选项为A。
Rn质子数是86,中子数是224-86=138.所以该原子的中子数和质子数之差是138-86=52.选项为A。
本题难度:一般