1、计算题 将盛有12gCuO的试管通入氢气后加热,当冷却后试管内的固体残渣为10g时,求氧化铜被还原的质量分数?
参考答案:83.3%
本题解析:此题经分析,12gCuO没有完全反应,生成物的残渣10g中也有没有反应的CuO。用常规解法较烦琐,如果用差量法则较为简便。但一定要分析清楚,减重的质量是哪种元素,在这题里减重的是CuO中的氧元素,它与H2结合成为H2O。根据方程式分析:设参加反应的CuO质量为y。
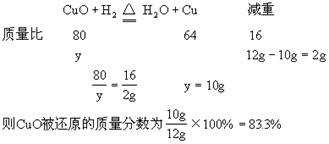
本题难度:简单
2、选择题 实验室为妥善保存硫酸亚铁溶液,常加入少量的
A.锌粉
B.铜片
C.铁片
D.镁粉
参考答案:C
本题解析:硫酸亚铁溶液中亚铁离子会发生水解,且易被氧气氧化为铁离子,所以妥善保存硫酸亚铁溶液时为了防止氧化可加入少量的铁粉,同时为了防止亚铁离子水解可加入少量稀硫酸;
本题难度:简单
3、实验题 Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为?;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式:?。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤
| 预期现象与结论
|
步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。
| ?
?;
|
步骤2:____________________________________
____________________________________。
| ?
|
?
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水,?。
参考答案:(1)2Fe2++Cl2=2Fe3++Cl-(3分) 2I-+Cl2=I2+2Cl-?(3分)
(2)(6分,各2分)
实验步骤
步骤1:…………………………………………
预期现象与结论
溶液变成黄色
步骤2:向试管中继续滴加几滴20%KSCN溶液
或:向试管中继续滴加几滴淀粉溶液
溶液不变血红色,证明I-的还原性强于Fe2+
或:溶液变蓝色,证明I-的还原性强于Fe2+
?
(3)滴加几滴20%KSCN溶液,无明显现象;再加入过量3%H2O2,溶液变血红色。(4分)
本题解析:(1)硫酸亚铁中滴加强化性的氯水,亚铁离子被氧化为铁离子,所以发生溶液变色,所以离子方程式为2Fe2++Cl2=2Fe3++Cl-?;而往碘化钾溶液中同样滴加氯水,还原性的I-被氧化成碘单质,形成棕黄色的碘水溶液,所以离子方程式为2I-+Cl2=I2+2Cl-。
(2)本探究实验的目的是以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+ 。要证明I-的还原性强于Fe2+ ,则可以设计让I-和Fe2+ 混合,然后滴加少量的强氧化剂,根据氧化还原规律,还原性强的先被氧化,所以滴加氯水试剂,只要证明先反应生成碘单质,而没有铁离子生成,即可得到结论。所以具体实验情况如下表:
实验步骤
步骤1:…………………………………………
预期现象与结论
溶液变成黄色
步骤2:向试管中继续滴加几滴20%KSCN溶液
或:向试管中继续滴加几滴淀粉溶液
溶液不变血红色,证明I-的还原性强于Fe2+
或:溶液变蓝色,证明I-的还原性强于Fe2+
?
(3)要证明碘与铁的化合物中铁显+2价,实质上就是利用(2)中提供的20%KSCN试剂来检验亚铁离子,所以正确的操作是:取少量样品溶于水,滴加几滴20%KSCN溶液,无明显现象;再加入过量3%H2O2,溶液变血红色,说明碘与铁的化合物中铁显+2价。
本题难度:一般
4、填空题 工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
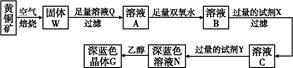
已知25 ℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
?
| Fe(OH)2
| Cu(OH)2
| Fe(OH)3
|
Ksp
| 8.0×10-16
| 2.2×10-20
| 4.0×10-38
|
完全沉淀pH
| ≥9.6
| ≥6.4
| ≥3.2
|
?
(1)加快黄铜矿焙烧速率,可采用的措施有?(写两种)。
(2)加入双氧水可能发生反应的离子方程式为?;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH的方法是? 。
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
(5)在溶液N中加入乙醇的目的是? 。
参考答案:(1)将黄铜矿粉碎、升高温度、增大空气流速(任选两种)
(2)2Fe2++2H++H2O2 2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
2Fe3++2H2O CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3中的任一种
(3)1×10-5 取一小片pH试纸放在玻璃片或表面皿上,用玻璃棒或胶头滴管取待测液点在pH试纸中部,待颜色变化稳定后与标准比色卡对比,读出pH
(4)K=
(5)降低G的溶解度,促进深蓝色晶体析出
本题解析:(1)对于固体反应物燃烧来讲,加快化学反应速率的措施有:①增大固体接触面积;②升高温度;③增大空气流速(即增大O2浓度);④利用超声波等;结合本题的情况,①②③都符合。
(2)从该题的工艺流程,再结合产物的阴离子,溶液Q应为H2SO4溶液,则溶液A中有:Fe2+、Fe3+、Cu2+和过量H2SO4,再结合所给数据,知此工艺应将Fe2+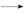 Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O
Fe3+,然后让Fe3+水解成Fe(OH)3沉淀滤去,而Cu2+则不能形成沉淀,而要保证Fe3+水解形成沉淀[由于Fe3++3H2O Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+
Fe(OH)3+3H+],则需要减小溶液酸性,所以双氧水的作用是将Fe2+氧化成为Fe3+,过量的试剂X的作用是能够促进Fe3+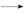 Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
Fe(OH)3,即要促进Fe3+水解向右进行,那么则需要消耗H+又不能引入新的杂质,结合题中物质应该加入含铜元素又能消耗H+且不引入杂质的物质,则X为CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3。
(3)由上面知溶液C主要为CuSO4溶液,则加入Y后能生成[Cu(NH3)4]SO4,则Y为氨水,NH3·H2O N
N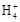 +OH-,K=
+OH-,K=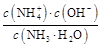 =
=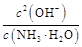 =
= =
=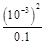 =
=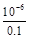 =10-5。
=10-5。
(4)书写时,氢氧化铜固体和水不计入表达式。
(5)深蓝色晶体的主要成分是[Cu(NH3)4]SO4·H2O,加入乙醇的目的是降低其溶解度,促进晶体析出。
本题难度:一般
5、选择题 、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是……( )
A.硫酸
B.碘水
C.硝酸锌
D.氯化铜
参考答案:C
本题解析:Fe溶于过量盐酸生成Fe2+,再加入Zn(NO3)2,在酸性条件下相当于加入了强氧化性的硝酸,则Fe2+被氧化成了Fe3+,而碘、较稀的硫酸和铜离子的氧化性均比Fe3+弱,不能氧化Fe2+。
本题难度:一般