1、填空题 (15分)
M、Q、X、Y、Z是前四周期的5种元素,原子序数依次增大,其结构或性质信息如下表:
元素
| 结构或性质信息
|
M
| M的一种单质是自然界最硬的物质
|
Q
| 基态原子最外层未成对电子数在该元素所在周期中最多
|
Y
| 单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子
|
?请回答以下问题:
(1)a.学生甲根据M原子易形成4对共用电子的特点,推出M原子应该具有4个未成对电子。画出基态M原子的价层电子排布图为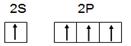 ,请判断对错,并加以解释?
,请判断对错,并加以解释?
b.M的另一种单质被称为混合型晶体,具有平面层状结构。M原子的杂化方式为________,其晶体中含有的作用力为________________________________________
(2)写出与Q单质分子互为等电子体的常见微粒的化学式(分子、阴离子各1个)?、?;并写出该阴离子的 电子式___________
电子式___________
(3)a.学生乙通过查表,确定Q与Y的电负性接近。但是Q的氢化物分子间能形成氢键,X的氢化物分子间却不易形成氢键,试从结构的角度加以解释:?
b.氢键的形成,对分子的沸点影响较大,请判断以下两种互为同分异构体的分子沸点高低:
邻羟基苯甲酸 ______ 对羟基苯甲酸,原因是_________________________________
c.含氧酸的酸性与非羟基氧的个数有关,则Y的四种常见的不同价态含氧酸的酸性由强到弱排序为:?
参考答案:

本题解析:略
本题难度:一般
2、选择题 由短周期元素和长周期元素共同组成的族可能是
A.主族
B.副族
C.Ⅷ族
D.Ⅶ族
参考答案:A
本题解析:副族与Ⅷ族属于长周期,不可能由短周期元素组成。没有Ⅶ族,要么是ⅦA,要么是ⅦB。
本题难度:简单
3、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是(?)
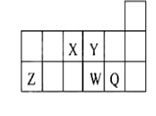
A.第一电离能和电负性: Z>W>Q
B.元素W的最高价氧化物对应的水化物的酸性比Q的强
C.离子半径X3-<Z 3+
D.元素X与元素Q二者的氢化物能化合生成离子化合物
参考答案:D
本题解析:根据元素在周期表中的相对位置可知,X是N、Y和O、Z是Al、W是S、Q是Cl。非金属性越强,电负性越大,所以第一电离能和电负性应该是Q>W>Z,A错误;氯元素的非金属性强于S因素的,所以高氯酸的酸性强于氯元素的,B错误;核外电子排布相同的微粒,其离子半径随原子序数的增大而减小,C不正确,离子半径应该是X3->Z 3+。氨气和氯化氢反应生成氯化铵,是离子化合物,D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、选择题 元素R有如下反应:RO3—+5R-+6H+===3R2+3H2O,下列说法正确的是(?)
A.元素R位于周期表中第ⅤA族
B.RO3—中的R只能被还原
C.每反应消耗1 mol RO3—,转移电子的物质的量为5 mol
D.R2在常温常压下一定是气体
参考答案:C
本题解析:根据反应式可知,R的最低价是-1价,所以最高价是+7价,即R是第ⅦA元素。RO中的R化合价是+5价,处于中间价态,既能被还原,也能被氧化。单质也可能是溴,所以只有选项C是正确的,答案选C。
本题难度:简单
5、填空题 周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:_________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
?。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的 水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)将足量的GD2通入EDA溶液中所得溶液的离子浓度的大小顺序为:?
参考答案:(1)非极性共价键、离子键
(2)N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol?三角锥形? sp3杂化
2NH3(g);△H=-92.2kJ/mol?三角锥形? sp3杂化
(3)Na3N + 4H2O=3NaOH + NH3·H2O
(4)1s22s22p63s23p63d104s1?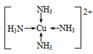 ?有深蓝色晶体析出
?有深蓝色晶体析出
(5)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
本题解析:根据题干信息:A是氢、B是碳、C是氮、D是氧、E是钠、F是铝、G是硫、H是铜。
(1)Na2O2中含有非极性共价键和离子键。
(2)信息表示合成氨的热化学方程式。
(3)Na3N能与水反应生成两种的碱NaOH和NH3·H2O
(4)Cu离子可以与水形成四水合铜配合物。
(4)将足量的SO2通入NaOH溶液中所得溶液为NaHSO3溶液,HSO3- H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O H2SO3+OH-,HSO3-电离的程度大于水解的程度,溶液呈酸性,溶液中各离子间的关系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
H2SO3+OH-,HSO3-电离的程度大于水解的程度,溶液呈酸性,溶液中各离子间的关系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
本题难度:一般