1、选择题 下面是四位同学对原子结构的的认识,你认为不正确的是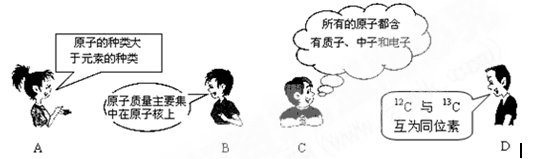
参考答案:C
本题解析:
分析:A、根据元素和核素的关系分析,元素是具有相同质子数的一类原子的总称.
B、原子是由原子核和电子构成,原子核的质量比电子大很多倍.
C、不是所以的原子都含有质子和中子,如11H.
D、质子数相同而中子数不同的原子互称同位素.
解:A、元素是一类原子,核素是一种原子,有些元素含有多种原子,所以原子的种类大于元素的种类,故A正确.
B、原子是由原子核和电子构成,原子核的质量比电子大很多倍,所以原子的质量主要集中在原子核上,故B正确.
C、不是所以的原子都含有质子和中子,如11H,故C错误.
D、质子数相同而中子数不同的原子互称同位素,12C、13C质子数相同中子数不同,所以是同位素,故D正确.
故选C.
本题难度:一般
2、选择题 已知34Se和35Br位于同一周期,下列关系正确的是
A.原子半径:Br>Se>Cl
B.热稳定性:HCl>H2Se>HBr
C.酸性:H2SeO4>HBrO4>HClO4
D.还原性:Se2—>Br—>Cl—
参考答案:D
本题解析:A、34Se和35Br位于同一周期,Se 在Br的左侧,原子半径Se>Br,错误;B、Br元素是非金属性强于Se,所以氢化物的热稳定性:HBr>H2Se,错误;C、高价含氧酸的酸性HBrO4>H2SeO4,错误;D、阴离子的还原性:Se2—>Br—>Cl—,正确。
本题难度:一般
3、填空题 碱金属元素原子最外层的电子数都是?个,碱金属元素中金属性最强的是?,原子半径最小的是?。卤素原子最外层的电子数都是?个,;在卤族元素中非金属性最强的是?。
参考答案:1;Cs;Li;7;F
本题解析:碱金属元素包括IA族除氢外的元素:锂、钠、钾、铷、铯、钫(放射性元素,中学阶段不研究)。最外层的电子数=主族序数=1;同主族,由上到下,元素的金属性增强;原子半径增大;
(VIIA族)卤素:F、Cl、Br、I、At(放射性元素,中学阶段不研究)。最外层的电子数=主族序数=7;同主族,由上到下,元素的非金属性减弱;
本题难度:简单
4、填空题 短周期元素A、B、X、Y、Z,原子序数依次减小,其中X、Y、Z原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物;B与X处于同周期,A+与B2-的核外电子排布相同,请回答:
(1)Y元素的名称是?;
(2)A、B两元素的单质在受热的条件下可以得到重要化合物,请写出该化合物的电子式:?;
(3)X、B、Z三种元素可以按照2:3:4的形式形成化合物,在该化合物中所含有的化学键类型为?;该化合物的水溶液呈?(填“酸性”、“碱性”“中性”);其原因是(用离子方程式表示) ? 。
(4)已知X单质与Z单质生成C的反应是可逆反应,△H < 0。将等物质的量的X、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有_________。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,X单质的体积分数始终为50%
c.达到化学平衡时,X、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大
(5)由Y和Z两种元素形成的相对分子质量为44的化合物的燃烧热为2220KJ/mol,请写出其热化学方程式:?。
参考答案:(1)碳?(2分)
(2)?
(3)离子键和共价键 (说明:可不答配位键)(2分)
酸性?(1分)? NH4+ + H2O  NH3·H2O + H+?(2分)
NH3·H2O + H+?(2分)
(4)ab?(3分)?(写对1个给1分,多写或写错没有分)
(5)C3H8 (g)+5O2(g)=3CO2(g)+4H2O(l) ;△H=-222OKJ/mol
(g)+5O2(g)=3CO2(g)+4H2O(l) ;△H=-222OKJ/mol
本题解析:略
本题难度:一般
5、选择题 某矿石由前20号元素中的四种组成,其化学式为WYZX4。X、Y、Z、W分布在三个周期,且?原子序数依次增大,Y、Z处于相邻主族,Y、W为金届元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。则下列判断正确的是
A.Y、Z的氧化物都有两性
B.气态氢化物的稳定性:Z>X
C.原子半径:W>Y>Z>X
D.最高价氧化物对应水化物的碱性:W<Y
参考答案:C
本题解析:原子序数X<Y<Z<W且为前20号元素分布在三个周期,由题意可知X元素为O元素,Y、Z为第三周期元素,W为第四周期元素。若W为K元素,则Y、Z最外层电子数之和等于7,可得Y元素为AL元素、Z元素为Si元素;若W为Ca元素,则Y、Z最外层电子数之和等于8不符合题意。所以A错,因为AL2O3为两性氧化物,而SiO2不是两性氧化物。B错,O元素的非金属性比Si元素非金属性强,氢化物稳定性更强。C对,根据电子层数越多半径越大,同一周期从左到右半径越小。D错,最高价氧化物对应的水化物碱性强弱与元素的金属性强弱有关,由于K元素金属性比AL元素金属性强。
本题难度:一般