1、填空题 (本小题14分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
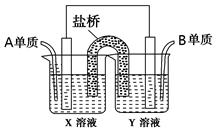
参考答案:(本小题14分,每空2分)(1)第三周期ⅥA族
(2)离子键、共价键(或非极性共价键) ; 2Na2O2+2H2O===4Na++4OH-+O2↑;
(3) (4) S2-+H2O
(4) S2-+H2O HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
HS-+OH-;(5) O2+4H++4e-===2H2O ;减小。
本题解析:根据题意可知:A是H;B是O;C是Na;D是S。(1)元素D在周期表中的位置是第三周期ⅥA族;(2)C2B2是Na2O2;属于离子化合物,在所含的化学键类型有离子键、非极性共价键;C2B2与A2B反应的离子方程式是2Na2O2+2H2O===4Na++4OH-+O2↑;(3)元素B、C形成的简单离子电子层结构相同,离子的核电荷数越大,离子半径就越小。所以离子半径较大的是O2-,其电子式是 ;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O
;(4)仅由C、D两种元素组成的一种盐Na2S是强碱弱酸盐,弱酸根离子S2-水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终当溶液达到电离平衡时,c(H+)<c(OH-),所以溶液显碱性, pH>7,用离子方程式表示是S2-+H2O HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。
HS-+OH-;(5)以C、D两元素的最高价氧化物的水化物X—NaOH、Y—H2SO4的溶液作为电解质溶液,A、B元素的单质H2、O2分别在两电极上发生原电池反应,则通入B单质的电极反应式为O2+4H++4e-===2H2O;通入A单质的电极反应式为H2-2e-+2OH-=2H2O,由于c(OH-)不断减小,所以溶液的pH会增大。
考点:考查元素及化合物的推断、物质的电子式、离子方程式和原电池的电极反应式的书写的知识。
本题难度:困难
2、填空题 某兴趣小组为了提高电池的效率,设计了下图所示的原电池。

请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应:
Al片( ) ____________________________,?
Cu片( ) ____________________________。?
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片( ) ____________________________,?
Cu片( ) ____________________________。?
参考答案:(1)负极 2Al-6e- 2Al3+
2Al3+
正极 6H++6e- 3H2↑
3H2↑
(2)正极 2N+4H++2e- 2NO2↑+2H2O
2NO2↑+2H2O
负极 Cu-2e- Cu2+
Cu2+
本题解析:(1)若X是AlCl3溶液,Y是稀硫酸,实质是由Al—稀硫酸—Cu组成的原电池,由于Al比Cu活泼,所以Al为负极,失电子,被氧化为Al3+,Cu为正极,溶液中的H+得电子,被还原为H2。
(2)若X是浓硝酸,Y是NaCl溶液,实质是由Al—浓硝酸—Cu组成的原电池,由于Al遇浓硝酸钝化,不能溶解,Al为正极,Cu为负极,失电子,被氧化为Cu2+。
本题难度:一般
3、选择题 铜锌原电池(如右下图)工作时,下列叙述正确的是
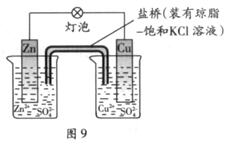
A.正极反应为:Zn—2e-=Zn2+
B.电池反应为:Zn+Cu2+=Zn2+ +Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
参考答案:B
本题解析:原电池中负极失去电子,正极得到电子。锌比铜活泼,是锌是负极,铜是正极,AC不正确,B正确。原电池中阳离子向正极移动,D不正确,答案选B。
本题难度:一般
4、填空题 由锌片、铜片和稀盐酸组成的原电池,正极的电极反应是_____________________,负极的电极反应是
___________________,原电池的总反应是______________________。
参考答案:2H++2e-=H2↑;Zn-2e-=Zn2+;Zn+2H+=Zn2++H2↑
本题解析:
本题难度:一般
5、选择题 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡,小心地从烧杯中央滴入CuSO4溶液。片刻后可观察到的现象是(指悬吊的金属圈)

[? ]
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
参考答案:D
本题解析:
本题难度:一般