1、填空题 (9分) 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化 铝的主要原料。工业上提取氧化铝的工艺流程如下:
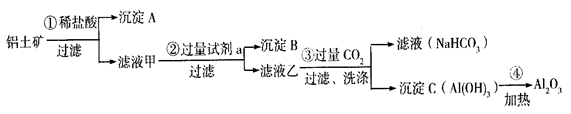
① 沉淀  A、B的成分分别是?、?;步骤②?中的试剂a是?;
A、B的成分分别是?、?;步骤②?中的试剂a是?;
② 试写出步骤③中发生反应的离子方式?__________?、
?__________?__________?;
③简述检验所得滤液甲 中存在Fe3+的操作方法:__________?_。
中存在Fe3+的操作方法:__________?_。
参考答案:(1)?① SiO2? Fe(OH)3? NaOH溶液(各1分)

本题解析:略
本题难度:一般
2、实验题 某课外兴趣小组为探究某种合金(含Mg、Al)中铝的含量,设计如图装置进行实验。

(1)如何检查该装置的气密性??。
(2)写出该合金与氢氧化钠溶液反应的离子方程式:?。
(3)使足量氢氧化钠溶液与a g合金(固体M)充分反应,进入量气管的气体体积为V mL(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是?。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,与a g合金粉末充分反应,则进入量气管内的气体体积?(填“>”、“<”或“=”)V mL;利用测得的气体体积能否对合金中的Al含量进行计算??(填“能”或“否”)。
参考答案:(1)安装好装置并在量气管中加水,向上(或向下)移动水准管,静置片刻。若水准管中液面与量气管液面维持一定的高度差,说明装置气密性良好
(2)2OH-+2Al+6H2O=2[Al(OH)4]-+3H2↑
(3)50%
(4)> 能
本题解析:(3)合金中只有Al可以和NaOH溶液反应,根据反应2OH-+2Al+6H2O=2[Al(OH)4]-+3H2↑,计算得参加反应的Al为0.018 g,可以求出合金中铝的质量分数为50%;(4)Mg和Al都可以与盐酸反应放出氢气,故改为盐酸后产生的气体体积比原来大,根据镁和铝与盐酸的反应可以列出方程组计算出合金中Al和Mg的质量。
本题难度:一般
3、选择题 下列叙述正确的是( )
A.合金的性质等于各成分金属的性质之和
B.单质铝既能溶于盐酸,又能溶于NaOH溶液
C.镁着火可以用CO2灭火器来灭火
D.最外层只有一个电子的元素一定是金属元素
参考答案:B
本题解析:
本题难度:简单
4、填空题 有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种。现做如下实验:
一、取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
二、另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。
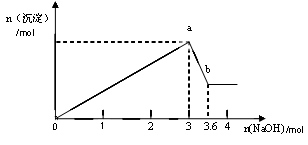
试推断:
(1)该溶液中一定存在__________?____,一定不存在________________。
(2)由图可知白色沉淀共有__________种,分别是__________________(填化学式),其物质的量比为?。
(3) 写出图中a b变化过程的离子方程式??。
b变化过程的离子方程式??。
参考答案:(1)Al3+、Mg2+、Cl-?; Fe3+、CO32-
(2)2;? Al(OH)3、Mg(OH)2?;?1:1
(3)Al(OH)3+ OH- AlO2-+ 2H2O
AlO2-+ 2H2O
本题解析:由于溶液是无色透明的,所以,首先排除Fe3+的存在,因为Fe3+的溶液呈棕黄色。取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成,说明该溶液中一定存在Cl-,因为只有AgCl白色溶液是不溶于稀HNO3的。另取部分溶液,加入氢氧化钠溶液,现象为先有沉淀,后沉淀消失,说明原溶液中一定存在Al3+、Mg2+,同时排除了CO32-的存在,因为Al3+、Mg2+与CO32--会反应,不能大量共存。而Na+与NO3-存不存在都对整个现象无影响。当沉淀的量达到最高时,再加入氢氧化钠溶液,沉淀部分消失,其原因是生成的氢氧化铝沉淀是两性氢氧化物,能与氢氧化钠溶液继续反应生成偏铝酸钠和水,而氢氧化镁沉淀则不能与氢氧化钠溶液反应。
本题难度:一般
5、选择题 下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3?②Al2O3?③Al(OH)3?④Al
A.①②③④
B.①②③
C.②③④
D.①②④
参考答案:A
本题解析:根据物质的性质可知,四种物质都和硫酸及氢氧化钠溶液反应,所以答案选A。
点评:既能跟盐酸反应又能跟NaOH溶液反应物质有Al、氧化铝、氢氧化铝、弱酸的酸式盐、弱酸的铵盐等。另外该题还需要注意的是看清楚题意,问的化合物还是单质。
本题难度:一般