1、选择题 在2只盛有100mL 1mol/L盐酸的烧杯中,分别加入ag碳酸镁、bg小苏打,反应完全后,两烧杯中的溶液质量仍相等,则a与b的关系中正确的是 [ ]
A.a=b>4.2g
B.a>b>6.2g
C.a=6.2g,b=8.4g
D.a=b<4.2g
参考答案:C.D
本题解析:等量的酸和不同的金属(或盐)反应,要保持溶液质量相等,实际上是要求投入溶解的金属质量减去反应后离开溶液的气体质量的差值相等。由于本题提供的酸是一具体数量,而不同盐的质量是变量,因此要从量上进行讨论。
HCl物质的量为0.1L×1mol/L=0.1mol,
MgCO3+2HCl==MgCl2+CO2↑+H2O
84g 2mol
a=4.2g 0.1mol
NaHCO3+HCl==NaCl+CO2↑+H2O
84g 1mol
b=8.4g 0.1mol
当a=b<4.2g时,MgCO3和NaHCO3均不足,放出的CO2均按盐的量计算,由于MgCO3和NaHCO3的摩尔质量相同,且每摩尔盐完全反应均放出1mol CO2,所以此时放出CO2的量也相等,反应后两烧杯中的溶液质量仍相等,满足题目要求。
当a=b>4.2g时,由上述分析可知MgCO3过量,NaH-CO3不足,此时两边放出CO2的量不相等,因此反应后两烧杯中溶液质量不可能相等。
当a=6.2g,b=8.4g时,MgCO3有余,放出CO2的量按HCl的量计算为2.2g,NaHCO3和HCl恰好反应完,放出CO24.4g,反应后加MgCO3的烧杯中质量增加为6.2g-2.2g=4g,加NaHCO3。的烧杯中质量增加为8.4g-4.4g=4g,也满足题目要求。
用类似方法分析知当a>b>6.2g时,反应后两烧杯中的溶液质量也不相等。
本题难度:简单
2、选择题 向10mL2mol/L的氯化铝溶液中加入0.5mol/L的烧碱溶液,反应得到沉淀0.78g,则加入的烧碱溶液的体积为
A.30mL
B.60mL
C.90mL
D.140mL
参考答案:BD
本题解析:氯化铝的物质的量为 若全部转化为沉淀时生成沉淀的质量为
若全部转化为沉淀时生成沉淀的质量为 ,此时消耗烧碱的体积是
,此时消耗烧碱的体积是 ,为120mL,当氢氧化钠不足时沉淀的质量会小于1.56g,当氢氧化钠溶液的体积大于120mL时,沉淀会发生溶解,导致沉淀质量小于1.56g,当氢氧化钠溶液体积小于120mL时,生成的沉淀时0.78g物质的量为0.01moL,消耗的氢氧化钠的物质的量为0.03moL,此时消耗氢氧化钠溶液的体积是
,为120mL,当氢氧化钠不足时沉淀的质量会小于1.56g,当氢氧化钠溶液的体积大于120mL时,沉淀会发生溶解,导致沉淀质量小于1.56g,当氢氧化钠溶液体积小于120mL时,生成的沉淀时0.78g物质的量为0.01moL,消耗的氢氧化钠的物质的量为0.03moL,此时消耗氢氧化钠溶液的体积是 ,即60mL,选B;当氢氧化钠的体积超过120mL时,部分氢氧化钠溶解,根据沉淀的质量可以得出溶解的氢氧化铝的质量是1.56-0.78=0.78g,溶解的氢氧化铝的物质的量是0.01moL,根据反应方程式可知溶解这一部分氢氧化铝消耗的氢氧化钠的物质的量是0.01moL,消耗氢氧化钠溶液的体积是
,即60mL,选B;当氢氧化钠的体积超过120mL时,部分氢氧化钠溶解,根据沉淀的质量可以得出溶解的氢氧化铝的质量是1.56-0.78=0.78g,溶解的氢氧化铝的物质的量是0.01moL,根据反应方程式可知溶解这一部分氢氧化铝消耗的氢氧化钠的物质的量是0.01moL,消耗氢氧化钠溶液的体积是 ,为20mL,此过程共消耗氢氧化钠溶液的体积是120+20=140mL,选D,所以答案选BD。
,为20mL,此过程共消耗氢氧化钠溶液的体积是120+20=140mL,选D,所以答案选BD。
本题难度:简单
3、选择题 用稀H2S04、NaOH溶液和Al为原料制取Al(OH)3,有下列三种不同的途径。
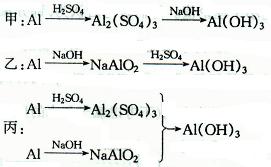
若制取等量的Al(OH)3,则?(?)
A.甲、乙消耗的源料同样多
B.丙消耗的原料最少
C.乙消耗的原料最少
D.三者消耗的原料同样多
参考答案:C
本题解析:略
本题难度:一般
4、选择题 铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中铝的含量超过国家标准就会对人体造成危害.下列关于铝元素的说法正确的是
[? ]
A.铝在空气中不易氧化是因为性质不活泼
B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物
C.明矾可用于饮用水的杀菌消毒
D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水
参考答案:B
本题解析:
本题难度:简单
5、计算题 取一定量的镁、铝混合粉末,加入1 mol·L-1的硫酸300 mL,使之完全溶解(酸过量);再加入过量的未知浓度的KOH溶液200 mL,得到5.8 g沉淀;过滤后向滤液中加入2 mol·L-1盐酸100 mL,恰好沉淀完全;将沉淀滤出,洗涤、干燥,称量为7.8 g。求:
(1)原来混合物中镁和铝的质量分数;
(2)所用KOH的物质的量浓度。
参考答案:原来混合物中镁和铝的质量分数分别为:47%、53%,所用KOH的物质的量浓度4 mol·L-1。
本题解析:(1)n(Mg)=n〔Mg(OH)2〕="5.8" g/58 g·mol-1="0.1" mol
n(Al)=n〔Al(OH)3〕="7.8" g/78 g·mol-1="0.1" mol
m(Mg)="0.1" mol×24 g·mol ="2.4" g
m(Al) ="0.1" mol×27 g·mol="2.7" g
w(Mg)=[2.4 g/(2.4 g+2.7 g)]×100%=47%
w(Al) =1-47%=53%
(2)恰好完全反应时溶液中存在的溶质是K2SO4、KCl,由电荷守恒得:n(K+)=2n( )+n(Cl-)="0.3" mol×2+0.2 mol="0.8" mol。
)+n(Cl-)="0.3" mol×2+0.2 mol="0.8" mol。
则c(KOH)="0.8" mol/0.2 L="4" mol·L-1。
本题难度:简单