1、选择题 将等质量的两份硅-铝合金分别投入足量的稀盐酸和足量的氢氧化钠溶液中,(提示:硅和铝相似也能与氢氧化钠溶液反应放出氢气)充分反应后,测得产生的气体的体积比为3:7(相同状况下),则该合金中硅和铝的物质的量之比为( )
A.3:7
B.7:3
C.2:1
D.1:1
参考答案:设原混合物中含有xmolSi,ymolAl,
硅不与盐酸反应,只与NaOH溶液反应,
硅-铝合金投入足量的稀盐酸中,发生反应2Al+6HCl=2AlCl3+3H2↑,
生成氢气的物质的量为:n(H2)=1.5n(Al)=1.5ymol,
硅-铝合金投入足量的氢氧化钠溶液中:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
1?3
y? 1.5y
Si+2NaOH+H2O=Na2SiO3+2H2↑
1? 2
x?2x
生成氢气的物质的量为:n(H2)=2xmol+1.5ymol,
根据题意可知:1.5y:(2x+1.5y)=3:7
解之得:x:y=1:1,
故选D.
本题解析:
本题难度:一般
2、选择题 含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见下表)
离子
| Mg2+
| Al 3+
| 物质
| Al(OH)3
|
开始沉淀pH
| 8.93
| 3.56
| 开始溶解pH
| 8.04
|
完全沉淀pH
| 10.92
| 4.89
| 完全溶解pH
| 12.04
|
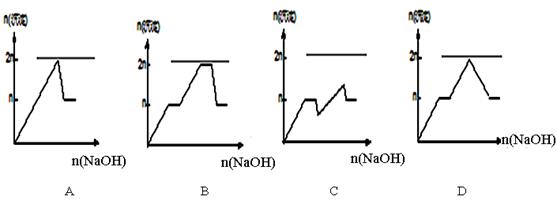
参考答案:C
本题解析:根据Mg2+、Al3+开始沉淀时的pH值可知,向MgCl2、AlCl3的混合溶液中滴NaOH溶液首先是氢氧化铝开始沉淀,当氢氧化铝开始溶解时Mg2+还没有开始形成沉淀。当pH=8.93时Mg2+开始形成沉淀,当pH=10.92时Mg2+完全沉淀此时氢氧化铝还没有完全溶解。当pH超过12.04时氢氧化铝完全溶解,因此符合反应过程的图像应该是C,答案选C。
本题难度:一般
3、选择题 下列物质能跟镁反应并生成氢气的是(?)
A.盐酸溶液
B.氢氧化钠溶液
C.氯化铵溶液
D.碳酸钠溶液
参考答案:AC
本题解析:镁是活泼金属,可与热水、酸性溶液反应生成氢气。题目所给的四个选项中,A选项为酸溶液,Mg+2HCl====MgCl2+H2↑;C选项中氯化铵水解呈酸性,亦可与镁发生反应生成氢气,反应的离子方程式为Mg+2 ====Mg2++2NH3↑+H2↑。
====Mg2++2NH3↑+H2↑。
本题难度:简单
4、选择题 14g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为 (? )
A.9.6g
B.6.4g
C.3.2g
D.1.6g
参考答案:C
本题解析:n(O2) =" 1.12/22.4" =" 0.05mol" , 0.05mol O2反应得到0.05ⅹ4 = 0.2mol电子
得NO,NO2和O2反应共失去0.2mol电子,即Cu,Ag和HNO3反应共失去0.2mol电子(得失电子守恒),所以有:2ⅹn(Cu) + n(Ag) = 0.2mol,由质量守恒得,有:64ⅹn(Cu) + 108ⅹn(Ag) =" 14g" ,解得n(Cu) = 0.05mol,即m(Cu) = 64ⅹ0.05 =" 3.2g" 。选C
点评:本题如果利用化学方程式来求解,计算过程将会很复杂,如果利用质量守恒与得失电子守恒,将会很好的简化计算。
本题难度:简单
5、选择题 称取两份铝粉,第一份加入足量的浓氢氧化钠溶液,第二份加入足量的稀盐酸,如要放出等体积的气体(在同温同压下),两份铝的质量之比为……( ?)
A.1:2
B.1:3
C.3:2
D.1:1
参考答案:D
本题解析:铝能与酸及强碱溶液发生氧化还原反应放出氢气。反应中铝均作还原剂,而产生的氢气都是由H+(盐酸或水中)得电子被还原而成的,根据在氧化还原反应中得、失电子总数相等的原则,可快速求解。
铝与盐酸反应时,由Al→Al3+;铝与浓NaOH反应时,Al→AlO2-,每摩铝均失去3摩电子。而产生氢气都是由H+(盐酸或水中)得电子被还原:2H++2e=H2↑,根据氧化还原反应中得失电子总数相等的原则,既然放出氢气的体积相等,那么在两个反应中消耗的铝的物质的量一定相等,故质量也相等,即应选D。
本题难度:一般