1、选择题 用含有少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为:①加盐酸溶解;②加苛性钠溶液;③过滤;④通入过量CO2;⑤加过量纯碱溶液,实验操作最合理的组合及顺序是( )
A.①⑤④③
B.②③④③
C.②③⑤③
D.①⑤③
参考答案:因镁与碱不反应,而铝可以与碱反应:2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,由于镁不溶解,过滤除去,NaAlO2要转变成Al(OH)3,可以向滤液中加入过量的二氧化碳,其反应为
NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓,再过滤即得纯净的Al(OH)3,实验操作最合理的组合及顺序为②③④③,
故选B.
本题解析:
本题难度:简单
2、填空题 某地有丰富的铝土矿和石灰石资源,拟用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)为原料冶炼铝,工艺流程如下图所示:

(1)原料A的名称是?,可循环使用的物质的化学式式为?。
(2)如果省去步骤①,即溶解铝土矿从直接加入B溶液开始,则最终会对氧化铝的生产产生的影响是?。
(3)写步骤③的离子方程式?。
(4)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,写出阴极的电极反应方程式?。
(5)工业常用阳极氧化法使铝的表面生成致密的氧化膜。如右图是铝阳极氧化实验装置图:a端是电源的?极。铝片表面形成氧化铝的原理是(用电极方程式表示)?,?(填“能”或“不能”)用较浓NaCl溶液代替20%H2SO4作电解液进行铝的阳极氧化,若不能,请说明理由?。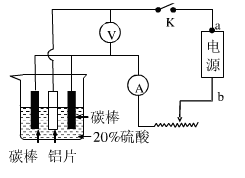
参考答案:(1)盐酸(或硫酸)(1分)? CaCO3和NaOH(2分)
(2)生成的氧化铝中含有二氧化硅杂质(2分)
(3)2AlO2-+CO2+3H2O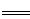 2Al(OH)3↓+CO32-(2分)(或AlO2-+CO2+2H2O
2Al(OH)3↓+CO32-(2分)(或AlO2-+CO2+2H2O Al(OH)3↓+HCO3-)
Al(OH)3↓+HCO3-)
(4)Al3++3e- Al(2分)
Al(2分)
(5)正(1分)? 2Al-6e-+3H2O Al2O3+6H+(2分)?不能(1分)?若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
Al2O3+6H+(2分)?不能(1分)?若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
本题解析:(1)SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀。由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠除去铁离子,将铝离子转化为AlO2-,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2。
滤液①中含有Al3+、Fe3+、Cl-、H+等,加入氢氧化钠,除去铁离子、氢离子,将铝离子转化为AlO2-,滤液2含有AlO2-,Cl-、Na+、,通入二氧化碳将偏铝酸根离子转化为氢氧化铝,所以滤液3中的离子主要有Na+、OH-、Cl-、HCO3-,步骤③通入二氧化碳与AlO2-反应生成的沉淀为氢氧化铝,反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,CaCO3 CaO+CO2↑,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸氢钠反应,NaHCO3+Ca(OH)2═CaCO3↓+NaOH+H2O,所以NaOH、CaCO3可再次被利用,即可循环使用。
CaO+CO2↑,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸氢钠反应,NaHCO3+Ca(OH)2═CaCO3↓+NaOH+H2O,所以NaOH、CaCO3可再次被利用,即可循环使用。
(2)如果省去步骤①,即溶解铝土矿是从加入原料B开始,用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质。
(3)步骤③通入二氧化碳与AlO2-反应生成的沉淀为氢氧化铝,二氧化碳少量时离子方程式为2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32-,二氧化碳过量时离子方程式为AlO2-+CO2+2H2O
2Al(OH)3↓+CO32-,二氧化碳过量时离子方程式为AlO2-+CO2+2H2O Al(OH)3↓+HCO3-
Al(OH)3↓+HCO3-
(4)三氧化铝熔融时电离出O2-和Al3+,阳离子在阴极放电,所以阴极的电极反应方程式Al3++3e- Al。
Al。
(5)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al-6e-+3H2O Al2O3+6H+,所以a端是电源的正极,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-
Al2O3+6H+,所以a端是电源的正极,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e- 3H2。?不能用较浓溶液代替20%H2SO4作电解液进行铝的阳极氧化,若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
3H2。?不能用较浓溶液代替20%H2SO4作电解液进行铝的阳极氧化,若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
本题难度:一般
3、选择题 下列现象或反应的原理解释正确的是( )
| 选项 | 现象或反应 | 原理解释
A
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔对熔化的铝有较强的吸附作用
B
合成氨反应需在高温条件下进行
该反应为吸热反应
C
镀层破损后,镀锡铁比镀锌铁易腐蚀
锡比锌活泼
D
2CO=2C+O2在任何条件下均不能自发进行
该反应△H>0,△S<0
|
A.A
B.B
C.C
D.D
参考答案:D
本题解析:
本题难度:一般
4、计算题 将一铝片投入500mL? 3mol/L的H2SO4溶液中。
(1)写出所发生反应的化学方程式并用双线桥分析电子转移的方向和数目。
(2)当生成11.2L(标准状况下)H2时,求此时溶液中H+的物质的量浓度。(假设溶液体积仍为500mL)
参考答案: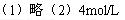
本题解析:略
本题难度:简单
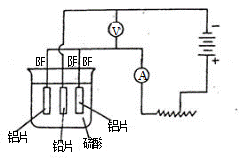
5、实验题 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜。
试回答下列问题
(1)用苯和酒精擦拭铝片的目的:??,氢氧化钠溶液处理铝片的目的是:??。
(2)下列有关说法正确的是?(填序号)。
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al +6H+ 2Al3+ +3H2↑
2Al3+ +3H2↑