1、选择题 酸和碱恰好完全中和时,它们起反应的?一定相等:
A.质量
B.物质的量
C.物质的量浓度
D.H+和OH―的物质的量
参考答案:D
本题解析:酸碱恰好完全中和时,其本质就是它们起反应的H+和OH―的物质的量刚好完全相等,故答案选D。
点评:本题关键在于如何很好的理解酸和碱恰好完全中和,实际上是指氢离子的物质的量等于氢氧根离子的物质的量。
本题难度:一般
2、选择题 已知在t℃,某Ba(OH)2稀溶液中,c(H+) = 10-a mol·L-1、c(OH-) = 10-b mol·L-1,且a+b=16。向该溶液中逐滴加入pH = c的盐酸,t℃下测得混合液的pH如下图所示
序号
| Ba(OH)2溶液体积/mL
| 盐酸体积/mL
| 混合液pH
|
1
| 22.00
| 0
| 10
|
2
| 22.00
| 18.00
| 9
|
3
| 22.00
| 22.00
| 8
|
假设混合时体积变化忽略不计,则c为
A、3? B、4? C、5? D、6
参考答案:D
本题解析:由题意可知该温度下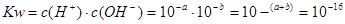 ,即当溶液的PH=8时,该溶液为中性,所以,可由第三组数据求得c=6;
,即当溶液的PH=8时,该溶液为中性,所以,可由第三组数据求得c=6;
本题难度:一般
3、选择题 25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后pH=7,则下列关系一定正确的是? (? )
A.a=b
B.a>b
C.c (A-)= c(Na+)
D.c (A-)< c(Na+)
参考答案:C
本题解析:
A只是可能正确,若一元酸HA为弱酸,则a>b,故错
B也是可能正确,HA是强酸的情况下,两者混合后溶液呈酸性pH<7,故错
C溶液反应后pH=7就是呈中性。那么[H+]=[OH-],HA与NaOH反应后,溶液中的离子就只有Na+、H+、OH-、A-,因为溶液呈现的是电中性,所以[Na+]+[H+]=[OH-]+[A-]
[H+]=[OH-],代入上式,就得[Na+]=[A-],所以C一定正确,那么D就不正确了。
点评:本题属于中等题,难度不大,做题时要考虑全面,一元酸HA既可能是强酸也可能是弱酸,分两种情况讨论。
本题难度:一般
4、选择题 用已知浓度盐酸滴定未知浓度的NaOH溶液时,下列操作使测定结果(NaOH溶液的浓度)偏高的是
A.滴定达终点时,俯视读数
B.碱液移入锥形瓶后,加入10mL蒸馏水
C.酸式滴定管用蒸馏水洗涤后,未用标准液润洗
D.滴定振荡锥形瓶过程中,有少量溶液溅出
参考答案:C
本题解析:根据C测=C标V标/V测可知,如果滴定达终点时,俯视读数,则读数偏小,消耗盐酸的体积减少,测定结果偏低;碱液移入锥形瓶后,加入10mL蒸馏水,并没有改变碱的物质的量,测定结果不变;酸式滴定管用蒸馏水洗涤后,未用标准液润洗,则盐酸的浓度降低,消耗盐酸的体积增加,测定结果偏高;滴定振荡锥形瓶过程中,有少量溶液溅出,碱液减少,消耗盐酸的体积减少,测定结果偏低,答案选C。
点评:该题是高考中的常见考点之一,试题难易适中,注重基础,侧重能力的考查。该题的关键是明确误差分析的总依据为:由C测==C标V标/V测 由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小。
本题难度:一般
5、选择题 已知反应:① 2C(s)+O2(g)=2CO(g)?ΔH=-22 1 kJ/mol
1 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l)?ΔH=-57.3 kJ/mol
下列结论正确的是:
A.碳的燃烧热大于110.5 kJ/ mol
mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀Ba(OH)2溶液反应生成1mol水放出的热量为57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量少于57.3 kJ
参考答案:AD
本题解析:略
本题难度:一般