|
高考化学知识点整理《热化学方程式》高频考点巩固(2017年模拟版)(八)
2017-11-11 01:03:04
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 热化学反应方程式中物质前的化学计量数表示
[? ]
A.分子数
B.原子个数
C.物质的量
D.物质的质量
参考答案:C
本题解析:
本题难度:简单
2、选择题 .已知:①2C(s)+O2(g)====2CO(g) ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g) ====2H2O(g) ΔH=-483.6 kJ·mol-1。则反应C(s)+H2O(g) ====CO(g)+H2(g)的ΔH为( )
A.+262.6 kJ·mol-1
B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1
D.+131.3 kJ·mol-1
|
参考答案:D
本题解析:根据盖斯定律可得反应C(s)+H2O(g) ====CO(g)+H2(g)的ΔH=(①-②)/2=(483.6-221)/2=+131.3kJ/mol,答案选D。
考点:考查盖斯定律的应用
本题难度:一般
3、简答题 按要求完成各题
(1)已知,1mol?N2(g)与足量O2(g)起反应,生成2mol?NO2(g),吸收68kJ的热量.该反应的热化学方程式可表示为:
______
(2)写出下列各物质的电离方程式:CH3COOH______;NH3?H2O______
(3)写出下列各物质水解的离子方程式:NaHCO3______;AlCl3______
(4)把足量的碳酸钙粉末放入水中,建立的溶解平衡可表示为:______.
参考答案:(1)1mol N2(g)与足量O2(g)起反应,生成2mol NO2(g),吸收68kJ的热量.标注物质聚集状态和对应量下的反应焓变,反应的热化学方程式为:N2(g)+2O2(g)?2NO2(g)△H=+68KJ/mol,
故答案为:N2(g)+2O2(g)?2NO2(g)△H=+68KJ/mol;
(2)醋酸和一水合氨是弱电解质存在电离平衡,电离方程式分别为:CH3COOH?CH3COO-+H+、NH3?H2O?NH4++OH-,
故答案为:?CH3COO-+H+;?NH4++OH-;
(3)碳酸氢钠水解生成碳酸和氢氧化钠,氯化铝水解生成氢氧化铝和氯化氢,水解的离子方程式分别为HCO3-+H2O?H2CO3+OH-、Al3++3H2O?Al(OH)3+3H+,
故答案为:HCO3-+H2O?H2CO3+OH-;Al3++3H2O?Al(OH)3+3H+;
(4)把足量的碳酸钙粉末放入水中形成饱和溶液,建立的溶解平衡可表示为:CaCO3(s)?Ca2+(aq)+CO32-(aq),
故答案为:CaCO3(s)?Ca2+(aq)+CO32-(aq).
本题解析:
本题难度:一般
4、填空题 (16分)CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍。具体反应为:

该正反应的ΔH 0(选填“>”或“=”或“<”)。
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g)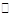 CH3CH2OH(g)+H2O(g) ΔH1 CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)="==" H2O(g) ΔH2
CO(g)+H2O(g)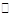 CO2(g)+H2(g) ΔH3 CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) 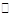 CH3CH2OH(g)+3H2O(l) ΔH CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(3)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)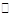 CH3OCH3(g)+H2O(g), CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有___ 。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+ 2H2(g)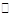 CH3OH(g) CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图28题-1)所示。

①合成甲醇的反应为__ __(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为__ __L。
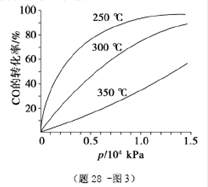
④(题28-图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图.当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.

⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(题28 -图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________。
参考答案:(1)<;(2)ΔH1 -3ΔH2-2ΔH3 (3)CE;
(4)①放热 ②KA=KB>KC ③2 ④
⑤在1.3×104Pa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本增加,得不偿失。
本题解析:(1)根据反应条件可知,温度低利于正反应的进行,温度高利于逆反应的进行,所以该反应的正反应是放热反应,ΔH<0;
(2)根据盖斯定律,将已知热化学方程式中含有的CO(g)、H2O(g)利用盖斯定律消去可得到2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l),则ΔH="ΔH1" -3ΔH2-2ΔH3; CH3CH2OH(g)+3H2O(l),则ΔH="ΔH1" -3ΔH2-2ΔH3;
(3)A、未指明正逆反应的方向,且氢气的速率应是CO速率的2倍,不能判断为平衡状态,错误;B、CO的消耗速率等于CH3OCH3的生成速率,都是正反应速率,但不符合化学计量数之比,不能判断为平衡状态,错误;C、容器的体积固定,该反应是气体的物质的量改变的可逆反应,所以当压强一定时,即为平衡状态,正确;D、容器的体积不变,混合气体的质量不变,所以混合气体的密度始终不变,不能判断为平衡状态,错误;E、混合气体的质量不变,但混合气体的物质的量发生改变,所以气体的平均相对分子质量发生变化,当气体的平均相对分子质量不变时,为平衡状态,正确,答案选CE;
(4)①温度升高,CO的转化率降低,说明温度升高,平衡逆向移动,逆向为吸热方向,所以合成甲醇是放热反应;
②平衡常数与温度有关,反应放热,则升高温度,平衡常数减小,A与B的温度相同,C的温度高于A、B,所以C的平衡常数较小,所以三者的关系是KA=KB>KC;
③达到平衡状态A时,容器的体积为10L,状态A与B的平衡常数相同,则A状态时CO的转化率是0.5,则平衡时CO的物质的量是10mol×(1-0.5)=5mol,浓度是0.5mol/L,氢气的物质的量是其2倍,为1mol/L,生成甲醇的物质的量是5mol,浓度是0.5mol/L,所以平衡常数K=1;设B状态时容器的体积是VL,B状态时CO的转化率是0.8,则平衡时,CO的物质的量是10mol×(1-0.8)=2mol,浓度为2/Vmol/L,氢气的物质的量是4/Vmol/L,生成甲醇的物质的量是8mol,浓度是8/V/mol/L,K=8/V/[2/V×(4/V)2]=1,解得V=2;
④使用催化剂可加快反应速率,缩短到达平衡的时间,但平衡状态不会改变,所以不使用催化剂到达平衡的时间加长,相同投料比时CO的转化率平衡时CO的转化率不变,但CO的转化率变化的程度较慢,图像见答案;
⑤从图3中可看出温度越低、压强越大CO的转化率越高,当在1.3×104Pa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本增加,得不偿失。
考点:考查化学平衡状态的判断,盖斯定律的应用,对图像的分析判断
本题难度:困难
5、填空题 (12分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。 2SO3(g)反应过程的能量变化如图所示。
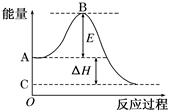
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示: _____;C点表示: (填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。
参考答案:(1)反应物的总能量;生成物的总能量(2)无 (3)-198
本题解析:(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义。
(2)E为活化能与反应热无关,但是用催化剂可以降低活化能。
(3)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1=-198kJ/mol
本题难度:一般
|