1、简答题 过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式______:
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是______(填序号)
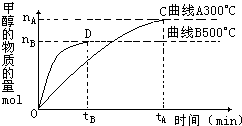
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
mol?(L?min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,增大
(3)25℃,1.01×105Pa时,16g?液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:______.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是______;正极的电极反应式:______.
2、选择题 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
[? ]
A.CH3OH(l)+ 3/2O2(g)==CO2(g)+2H2O(l) △H=+725.8kJ/mol
B.2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(l) △H=-1452kJ/mol
C.2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(l) △H=-725.8kJ/mol
D.2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(l) △H=+1452kJ/mol
3、选择题 下列热化学方程式正确的是(注:△H的绝对值均正确)( ? )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0?kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热)
C.S(s)+O2(g)═SO2(g)△H=-269.8kJ/mol(反应热)
D.2NO2═O2+2NO△H=+116.2kJ/mol(反应热)
4、填空题
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下:
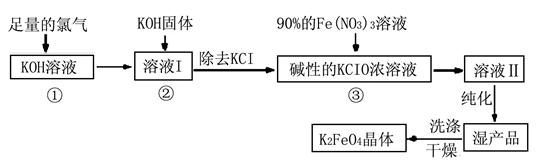
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
A.为下一步反应提供碱性的环境
B.使KClO3转化为KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度
 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,