| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《盐类水解的原理》试题巩固(2017年最新版)(八)
参考答案:C 本题解析::若HA为强酸,a=b;若HA为弱酸,则a>b,但无论HA是强酸还是弱酸,均有电荷守恒: 本题难度:一般 3、填空题 现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题: 参考答案: 本题解析: 本题难度:一般 4、选择题 有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度相等,下列说法正确的是 |
参考答案:C
本题解析:A.等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸的酸性小于醋酸的,所以三种溶液pH的大小顺序是③>①>②,故A错误;B.稀释时强碱的变化程度大,所以三种溶液稀释相同倍数,pH变化最大的是③,故B错误;C.等体积等浓度混合后,①中溶质为NaHCO3、NaCl,②中溶质为NaCl、CH3COOH,③中溶质为NaCl,HCO3-离子水解显碱性,所以pH最大的是①,C正确;D.三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(Na2CO3)>c(CH3COONa)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是①>②>③,故D错误;故选C.
考点:盐类水解的应用
本题难度:一般
5、填空题 (10分)常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。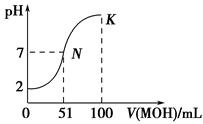
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是_________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因: 。
(3)若此时溶液的pH=10,则c(MOH)+c(OH-)=________mol·L-1。
参考答案:(1)强酸 0.01 mol·L-1 HA溶液的pH=2,说明完全电离(2) < M+ + H2O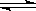 MOH + H+ 0.005
MOH + H+ 0.005
本题解析:(1)分析图像中的pH变化曲线,起始时溶液的pH值为2,说明HA酸完全电离则为一元强酸。(2)由于是向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,可知当加入50mL时,两者恰好完全反应,此时溶液的pH值小于7,说明碱是一元弱碱,MA就是强酸弱碱盐,水解溶液显酸性,M+水解的离子方程式为:M+ + H2O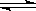 MOH + H+(3)若K的对应pH=10,根据物料守恒,则溶液中c(MOH)+c(M+)=10-2mol·L-1,HA为一元强酸,故c(A-)=0.005mol·L-1,根据溶液中的电荷守恒,可得出:c(A-)+ c(OH-)=" c" (H+)+ c(M+),将上述两式代入可得:c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1,c (H+)忽略不计,故:c (MOH)+ c(OH-)=0.005mol·L-1
MOH + H+(3)若K的对应pH=10,根据物料守恒,则溶液中c(MOH)+c(M+)=10-2mol·L-1,HA为一元强酸,故c(A-)=0.005mol·L-1,根据溶液中的电荷守恒,可得出:c(A-)+ c(OH-)=" c" (H+)+ c(M+),将上述两式代入可得:c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1,c (H+)忽略不计,故:c (MOH)+ c(OH-)=0.005mol·L-1
考点:结合图像考查了水溶液的pH值、电离水解等知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的组成.. | |