|
|
|
高中化学必备知识点《盐类水解的原理》试题巩固(2017年最新版)(七)
2017-11-11 01:07:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列实验不能达到预期目的的是:
序号
| 实验操作
| 实验目的
| A
| 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸
| 抑制Fe2+水解和防止Fe2+被氧化
| B
| 将饱和FeCl3溶液滴入沸水中,溶液变红褐色
| 制备Fe(OH)3胶体
| C
| 测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大
| 比较S、C的非金属性强弱
| D
| 将充满NO2的密闭玻璃球浸泡在热水中
| 研究温度对化学平衡移动的影响
|
2、选择题 25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a=b
B.a>b
C.c (A-)= c(Na+)
D.c (A-)< c(Na+)
|
3、填空题 现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____________。
(2)④、⑤、⑥、⑦四种溶液中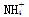 浓度由大到小的顺序是(填序号)________。 浓度由大到小的顺序是(填序号)________。
(3)将③和④按体积比1
4、选择题 有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度相等,下列说法正确的是
A.3种溶液pH的大小顺序是 ③>②>①
B.若分别滴加25mL和上述溶液等浓度的盐酸后,pH最大的是①
C.若将3种溶液稀释相同倍数,pH变化最大的是②
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
|
5、填空题 (10分)常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。
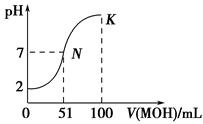
回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是_________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因: 。
(3)若此时溶液的pH=10,则c(MOH)+c(OH-)=________mol·L-1。
