| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《盐类水解的原理》试题巩固(2017年最新版)(十)
参考答案:C 本题解析: 本题难度:一般 2、选择题 将0.4 mol/L的CH3COOK与0.2 mol/L的HCl等体积混合后,溶液中下列微粒的物质的量浓度关系正确的是 参考答案:D 本题解析: 本题难度:困难 3、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是 |
参考答案:D
本题解析:A、根据电荷守恒可知c(K+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),A不正确;B、强碱弱酸盐水解溶液应呈碱性c(H+)<c(OH—),B不正确;C、根据物料守恒可知c(K+)=2c(S2-)+2c(HS-)+2c(H2S),C不正确;
D、根据质子守恒可知c(OH-)=c(H+)+c(HS-)+2c(H2S),D正确。
考点:了解盐类水解的原理、盐溶液酸碱性、影响盐类水解程度的主要因素、盐类水解的应用。
点评:主要考查对盐类水解判断溶液酸碱性、电解质溶液中三“守恒”等考点的理解。电荷守恒式注意关注离子电荷数,物料守恒重点是弄清所考查原子的个数比,质子守恒应重点分析H+与失去H+所得到的离子的去向。
本题难度:一般
4、选择题 已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3
参考答案:
本题解析:
本题难度:困难
5、填空题 写出下列盐溶液的水解离子方程式:
(1)Fe(NO3)3 ;
(2)NaF ;
(3)K2CO3 ; ;
参考答案:(1)Fe3+ +3H2O 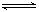 Fe(OH)3 + 3H +
Fe(OH)3 + 3H +
(2)F- +H2O 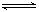 HF + OH-
HF + OH-
(3)CO32-+H2O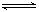 HCO3-+ OH- ;
HCO3-+ OH- ;
HCO3-+H2O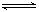 H2CO3+ OH-
H2CO3+ OH-
本题解析:(1)多元弱碱阳离子一步水解
(3)多元弱酸的酸根离子要分多步水解
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的组成.. | |