1、填空题 海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图:
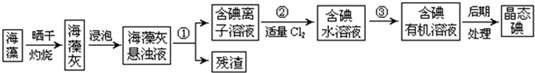
(1)指出提取碘的过程中有关的实验操作名称:①______,③______;
(2)提取碘的过程中,可选择的有机试剂是______.
A.酒精?B.四氯化碳?C.苯
(3)实验操作③中,实验室已有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是______.
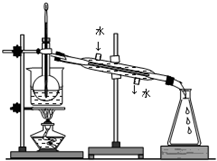
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出实验装置图中的错误之处:
①______;
②______;
③______.
(5)进行上述蒸馏操作时,使用水浴加热的原因是:______,最后晶态碘在______里聚集(填仪器名称).
参考答案:(1)①分离固体和液体用过滤,③将碘水中的碘单质萃取出来,选择合适的萃取剂即可,
故答案为:过滤;萃取、分液;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用四氯化碳或苯,
故答案为:BC;
(3)海藻灰中碘离子转化为碘的有机溶液,需要用到分液,分液需要用到分液漏斗、锥形瓶,
故答案为:分液漏斗;锥形瓶;
(4)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平.
故答案为:缺石棉网;温度计插到了液体中;冷凝管进出水的方向颠倒;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.四氯化碳沸点:
76.8℃,碘单质沸点为184℃,故最后晶态碘在蒸馏烧瓶里聚集,
故答案为:受热比较均匀,温度容易控制;蒸馏烧瓶.
本题解析:
本题难度:一般
2、选择题 海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法不正确的是
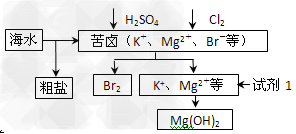
[? ]
A.可用BaCl2溶液除去粗盐中的SO42-
B.从苦卤中提取Br2的反应的离子方程式为:2Br-?+?Cl2?==?2Cl-?+?Br2
C.试剂1可以选用石灰乳
D.工业上,电解熔融Mg(OH)2冶炼金属镁
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列海水综合利用的过程中,可不涉及化学变化的是?
[? ]
A.海水制淡水
B.海水制纯NaCl
C.海水制镁
D.海水制溴
参考答案:A
本题解析:
本题难度:简单
4、选择题 关于海洋与化学的下列说法不正确的是( )
A.海水中所含有的元素大部分以盐的形式存在
B.海水经过加碱、加酸后,浓缩、过滤、干燥、电解制得金属镁
C.元素周期表中列出的元素目前有80多种能在海水中找到
D.海水中的常量元素具有开发的价值而微量元素不具有开发的价值
参考答案:D
本题解析:
本题难度:简单
5、填空题 海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.试回答下列问题:
(1)海水中含有大量的氯化钠.氯化钠中的金属元素化合价为______.
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是______(填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O→NaOH+H2+Cl2(未配平).该反应中食盐的化学式是______.利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐______t.
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下:
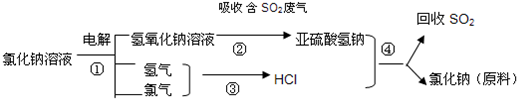
写出①③的化学反应方程式:______,______.
参考答案:(1)氯化钠中 的钠元素原子最外层电子是1,失去最外层电子化合价为+1价,故答案为:+1;?
(2)由于蒸馏法只是水的状态由液态到气态再到液态的过程,所以属于物理变化;故答案为:物理变化;
?(3)电解饱和食盐水反应的化学方程式为:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑;食盐为氯化钠,NaCl;
H2+Cl2=2HCl;2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑;假设反应过程中无损耗,生成的氢气和氯气全部生成氯化氢,则依据元素守恒可知氯化钠中的氯元素全部转化为氯化氢中的氯元素,依据守恒计算得到:用电解所得气体制36.5%的浓盐酸100t,氯化氢质量为36.5t,NaCl~HCl,最少需要消耗食盐58.5t;
故答案为:NaCl;58.5;?
(4)反应①是电解饱和食盐水的反应生成氢气、氯气、氢氧化钠,反应的化学方程式为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑;
反应③是氢气和氯气反应生成氯化氢,反应的化学方程式为:H2+Cl2?点燃?.?2HCl;
故答案为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑;H2+Cl2?点燃?.?2HCl.
本题解析:
本题难度:一般