1、填空题 探究硫酸铜的量对氢气生成速率的影响,设计如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需时间。
实验
混合溶液
| ? A
| ? B
| ? C
| ? D
| ? E
| ? F
|
4mol/L? H2SO4/mL
| ? 30
| ? V1
| ? V2
| ? V3
| ? V4
| ? V5
|
饱和CuSO4溶液/mL
| ? 0
| ? 0.5
| ? 2.5
| ? 5
| ? V6
| ? 20
|
H2O/mL
| ? V7
| ? V8
| ? V9
| ? V10
| ? 10
| ? 0
|
完成此实验设计,其中:V9=?
2、选择题 下列有关化学反应速率的说法正确的是
[? ]
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B.100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
3、选择题 影响化学反应速率的因素很多,下列措施能使5%?H2O2溶液分解的反应速率减小的是( )
A.升高温度
B.降低温度
C.使用MnO2作催化剂
D.增大反应物浓度
4、填空题 在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
?
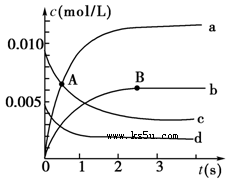
(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)?b.容器内压强保持不变
c.v逆(NO)=2v正(O2)?d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体?b.适当升高温度
c.增大O2的浓度?d.选择高效的催化剂
5、简答题 (14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器
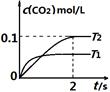
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H?0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为?。
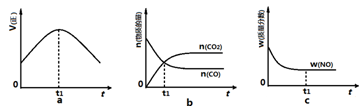
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是?(填字母编号)。
 ?
? ?
?
图1?图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol? ①
2NO2(g) N2O4(g)? △H=-56.9 kJ/mol? ②
N2O4(g)? △H=-56.9 kJ/mol? ②
H2O(g)=H2O(l)? △H=-44.0 kJ/mol? ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式?。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①该燃料电池的负极反应式为?。
②电解后溶液的pH约为?(忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为?L。