1、填空题 探究硫酸铜的量对氢气生成速率的影响,设计如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需时间。
实验
混合溶液
| ? A
| ? B
| ? C
| ? D
| ? E
| ? F
|
4mol/L? H2SO4/mL
| ? 30
| ? V1
| ? V2
| ? V3
| ? V4
| ? V5
|
饱和CuSO4溶液/mL
| ? 0
| ? 0.5
| ? 2.5
| ? 5
| ? V6
| ? 20
|
H2O/mL
| ? V7
| ? V8
| ? V9
| ? V10
| ? 10
| ? 0
|
完成此实验设计,其中:V9=?
参考答案:V9=17.5
本题解析:要探究硫酸铜的量对氢气生成速率的影响,则硫酸铜溶液和水的体积之和应该始终是保持相同的,根据表中数据可知二者之和20.0ml,所以V9=20.0ml-2.5ml=17.5ml。
本题难度:一般
2、选择题 下列有关化学反应速率的说法正确的是
[? ]
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B.100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
参考答案:D
本题解析:
本题难度:一般
3、选择题 影响化学反应速率的因素很多,下列措施能使5%?H2O2溶液分解的反应速率减小的是( )
A.升高温度
B.降低温度
C.使用MnO2作催化剂
D.增大反应物浓度
参考答案:A.升高温度,反应速率加快,故A不选;
B.降低温度,反应速率减小,故B选;
C.使用MnO2作催化剂,反应速率加快,故C不选;
D.增大反应物的浓度,反应速率加快,故D不选;
故选B.
本题解析:
本题难度:一般
4、填空题 在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
?
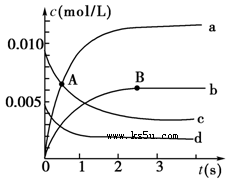
(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)?b.容器内压强保持不变
c.v逆(NO)=2v正(O2)?d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体?b.适当升高温度
c.增大O2的浓度?d.选择高效的催化剂
参考答案:(1)大于 大于 (2)b 1.5×10-3mol/(L·s)?(3)bc (4)bcd
本题解析:(1)NO是反应物,起始浓度是0.020mol÷2L=0.010mol/L,所以曲线c表示NO的浓度变化曲线。A点NO的浓度继续降低,没有达到平衡状态,反应仍然是向正反应方向进行的,正反应速率大于逆反应速率,所以A点正反应速率大于B点正反应速率。
(2)NO2是生成物,在反应过程中浓度是增大的。由表中数据可知,平衡时c(NO)=0.007mol/L÷2L=0.0035mol/L。曲线b平衡时的浓度为0.0035mol/L,根据反应方程式中的化学计量数可知,曲线b表示NO2的浓度变化曲线。反应进行到2s是,NO浓度减少了0.010mol/L-0.004mol/L=0.006mol/L,所以氧气的浓度变化量是0.003mol/L,则氧气的反应速率是0.0030mol/L÷2s=1.5×10-3mol/(L·s)。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,故a错误;b.随反应进行气体的物质的量减小,压强逐渐减小,因此容器内压强保持不变时,可以说明到达平衡,故b正确;c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),可以说明到达平衡,故c正确;d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故d错误,答案选bc。
(4)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;b.适当升高温度,反应速率增大,平衡向逆反应移动,故b正确;c.增大O2的浓度,反应速率增大,平衡向正反应移动,故c正确;d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d正确,答案选bcd。
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,基础性强,侧重对学生能力的培养,有利于调动学生的学习兴趣,有助于培养学生的逻辑推理能力和创新思维能力。难点是平衡状态的判断,答题时应注意平衡状态判断选择判断的物理量,应随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
本题难度:一般
5、简答题 (14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。在密闭容器
2CO2(g)+ N2(g)。在密闭容器
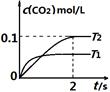
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H?0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为?。
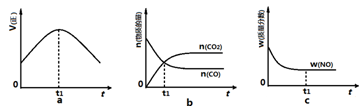
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是?(填字母编号)。
 ?
? ?
?
图1?图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol? ①
2NO2(g) N2O4(g)? △H=-56.9 kJ/mol? ②
N2O4(g)? △H=-56.9 kJ/mol? ②
H2O(g)=H2O(l)? △H=-44.0 kJ/mol? ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式?。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①该燃料电池的负极反应式为?。
②电解后溶液的pH约为?(忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为?L。
参考答案:(14分)(每空2分)(1)①<? ②0.025mol/(L·s) ?③c
(2)N2O4(g)+CH4(g)=N2(g)+2H2O(l)+CO2(g)? △H=-898.1kJ/mol
(3)①CH4-8e-+2H2O= CO2+8 H+?②14? ③1.68
本题解析:(1)①根据化学平衡中“先拐先平”的规律,T1>T2,则温度升高,二氧化碳浓度减小,说明升温平衡逆向移动,所以正向是放热反应△H<0;
②2s内二氧化碳的浓度增加0.1mol/L,则氮气的浓度增加0.05mol/L,所以v (N2)=0.05mol/L/2s=0.025mol/(L·s);
③图a中t1时刻说明正反应速率最大,因为该反应为放热反应,容器为绝热容器,所以开始时相当于给体系升温,温度升高,反应速率加快,但同时升温不利于正反应的进行,所以正反应速率后来又逐渐减小,当正反应速率不再变化时说明达平衡状态,因此t1时刻未达到平衡状态;b图中t1时刻的一氧化碳和二氧化碳的物质的量相等,不能说明t1时刻达到平衡状态;c图中t1时刻NO的质量分数不再变化,说明已达平衡状态,正确,答案选c。
(2)根据盖斯定律,目标方程式=①-②+2×③,所以CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式为N2O4(g)+CH4(g)=N2(g)+2H2O(l)+CO2(g)? △H=-898.1kJ/mol
(3)①燃料电池中的负极是燃料发生氧化反应,所以该燃料电池的负极反应式为CH4-8e-+2H2O= CO2+8 H+
②食盐水中的Cl-的物质的量是0.1mol,若按电解食盐水的化学方程式中2NaOH~H2~Cl2,当生成0.1mol氢气时,应生成0.1mol氯气,与题意不符,所以电解食盐水开始是Cl-和H+放电,Cl-放电完毕后是OH-放电,因此溶液中氢氧化钠的物质的量为0.05mol×2=0.1mol,所以c(OH-)=0.1mol/0.1L=1mol/L,溶液pH=14;
③根据②的分析,阳极产生0.05mol的氯气和0.025mol的氧气,所以标准状况下的体积是1.68L。
本题难度:一般