1、选择题 下列叙述正确的是
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
参考答案:B
本题解析:氨气中心原子氮原子是sp3杂化,含有1对孤对电子,是三角锥形,属于极性分子,A不正确。水中心原子氧原子是sp3杂化,含有2对孤对电子,是V形,属于极性分子,B正确。四氯化碳中心原子碳原子是sp3杂化,没有孤对电子,是正四面体型,属于非极性分子,C不正确。CO2中心原子碳原子是sp杂化,是直线型结构,属于非极性分子,D不正确。答案选B。
本题难度:一般
2、选择题 下列微粒空间构型为平面三角形的是( )?
A.NF3
B.HCHO?
C.PCl3
D.H3O+
参考答案:B?
本题解析:HCHO中的C原子采取的是sp2杂化,三个杂化轨道呈平面三角形,2个sp2杂化轨道分别与一个H原子形成一个C-Hσ键,另一个sp2杂化轨道与O原子形成一个σ键,C原子中未用于杂化的p轨道与O原子的p轨道形成一个π键,空间构型为平面三角形。NF3、PCl3、H3O+中心原子均采取sp3杂化,4个杂化轨道呈正四面体形,由于3个杂化轨道形成化学键,有1个杂化轨道被孤对电子占据,所以分子空间构型为三角锥形。?
本题难度:一般
3、选择题 下列物质中含有共价键的离子化合物是
[? ]
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦Mg3N2
A.②③④
B.①③④⑦
C.①②④⑦
D.③④⑥
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列四种元素中,其单质氧化性最强的是( )
A.原子含未成对电子最多的第二周期元素
B.原子最外层电子排布为2s22p4的元素
C.位于周期表中第三周期ⅢA族的元素
D.原子最外层电子排布为3s23p3的元素
参考答案:A、原子含未成对电子最多的第二周期元素是N元素,氮气的化学性质稳定;
B、原子最外层电子排布为2s22p4的元素是O元素,
C、位于周期表中第三周期ⅢA族的元素是Al元素,
D、原子最外层电子排布为3s23p3的元素是P元素,
非金属性O>N>P,氧气的氧化性最强,
故选B.
本题解析:
本题难度:简单
5、计算题 金属铜的导电性仅次于银,大量用于电气工业。
(1)写出铜的基态原子价电子电子排布式________。
(2)铜的某种氯化物晶体的晶胞结构如右图所示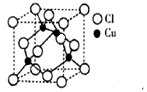 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。
(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体。氨分子中N原子的杂化方式为__________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比pH3大,其原因是________________________________。
参考答案:(1)(2分)3d104s1?(2)(1分)CuCl?(3)sp3(1分)离子键(1分)配位键(1分)
(4)(2分)NH3分子之间有氢键作用,故沸点明显高于pH3
本题解析:(1)Cu是29号元素,原子核外电子数为29。根据构造原理和洪特规则可知,铜的基态原子价电子电子排布式3d104s1。
(2)由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上。实验依据均摊法可知晶胞中含有Cl原子数目为8×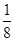 +6×
+6×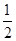 =4,所以两种原子的个数之比是1:1,因此该氯化物的化学式为CuCl。
=4,所以两种原子的个数之比是1:1,因此该氯化物的化学式为CuCl。
(3)NH3分子中N原子形成3个N-H键,含有(5-3×1)÷2=1对孤对电子,杂化轨道数目为4,采取sp3杂化;在该晶体中Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,NH3分子中N、H原子之间以共价键结合,[Cu(NH3)4]2+与SO42-以离子键结合。
(4)氮原子电负性较大,导致NH3分子之间有氢键作用,而pH3中不存在氢键,所以NH3的沸点比pH3高。
本题难度:一般