1、选择题 反应C(s)+H2O(g)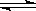 CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是
CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是
A.增加固体C的量
B.加入适当的催化剂
C.保持压强不变,充入惰性气体使容器容积增大
D.保持容器容积不变,充入惰性气体使体系压强增大
参考答案:AD
本题解析:略
本题难度:简单
2、填空题 在温度t1和t2下,X2(g)和 H2反应生成HX的平衡常数如下表:
化学方程式
| K (t1 )
| K (t2)
|
 ? ? 2 2
| 1.8 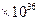
| 
|
| 
| 
|
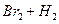  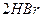
| 
| 
|
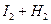  2HI 2HI
| 43
| 34
|
(1)已知t2〉t1,HX的生成反应是?反应(填“吸热”或“放热”)。
(2)HX的电子式是??。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是??。
(4)X2都能与H2反应 生成HX,用原子结构解释原因:??。
生成HX,用原子结构解释原因:??。
(5)K的变化体现出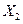 化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,平衡于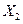 的转化率逐渐降低
的转化率逐渐降低
b. 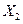 与
与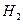 反应的剧烈程度逐渐减弱
反应的剧烈程度逐渐减弱
c. HX的还原性逐渐
d. HX的稳定性逐渐减弱
参考答案:

本题解析:略
本题难度:简单
3、填空题 在一定体积的密闭容器中,进行反应CO2(g)+H2(g)?CO(g)+H2O(g).其平衡常数K和温度T的关系如表所示:
| T/℃ | 700 | 800 | 830 | 1000 | 1200
K
0.6
0.9
1.0
1.7
2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______
(2)该反应为______反应(填“吸热”或“放热”)
(3)能判断该反应达化学平衡状态的依据是______
A:容器中压强不变?B:混合气体中C(CO)不变
C:V(H2)正=V(H2O)逆D:C(CO2)=C(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)?C(H2)=C(CO)?C(H2O)试判断此时的温度______
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为C(CO2)?为2mol/L,C(H2)为1.5mol/L,C(CO)?为1mol/L,C(H2O)为3mol/L,则此时刻反应向______(填“正向”或“逆向”)进行.
参考答案:(Ⅱ)(1)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,则CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K=C(CO).C(H2O)C(CO2).C(H2);
故答案为:C(CO).C(H2O)C(CO2).C(H2);
(2)由温度升高,平衡常数变大可知,升高温度,平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
(3)A.该反应为气体的物质的量不变的反应,则容器中压强始终不变,不能作为判定平衡的方法,故A错误;?
B.混合气体中C(CO)不变,则达到化学平衡,故B正确;
C.V(H2)正=V(H2O)逆,则对于氢气来说正逆反应速率相等,则达到平衡,故C正确;
D.c(CO2)=c(CO),该反应不一定达到平衡,浓度关系取决于反应物的起始量和转化率,故D错误;
故答案为:BC;
(4)C(CO2)?C(H2)=c(CO)?c(H2O)时,平衡常数K=1,则该温度为830℃,故答案为:830.
(5)C(CO).C(H2O)C(CO2).C(H2)=1mol/L.3mol/L2mol/L.1.5mol/L=1>K,所以化学平衡向逆反应方向移动,故答案为:逆向.
本题解析:
本题难度:简单
4、选择题 对于在恒容、恒温密闭容器中进行的反应H2(g)+I2(g)

2HI(g),能说明其达到化学平衡状态的是( )
A.容器中气体压强不变
B.容器中气体密度不变
C.容器中气体颜色的深浅不变
D.同时间内生成的H2、I2的物质的量相同
参考答案:A、该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,容器中气体压强始终不变,故A错误;
B、反应前后气体的总质量不变,容器的体积不变,无论该反应是否达到平衡状态,容器内气体密度始终不变,故B错误;
C、当反应达到平衡状态时,各物质的浓度不再变化,所以容器内气体颜色的深浅不变,故C正确;
D、无论该反应是否达到平衡状态,同时间内生成的H2、I2的物质的量始终相同,故D错误;
故选C
本题解析:
本题难度:一般
5、选择题 如图2所示,反应3A(g)+B(g)  2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是(?)
2C(g)△H<0,随不同温度(T1>T2)。不同压强(P2>P2)或不同时间(t),混合气中C的体积分数C%变化的曲线中,下列图像错误的是(?)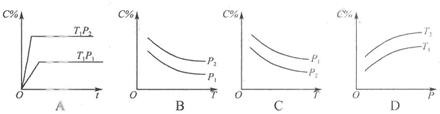
参考答案:C
本题解析:略
本题难度:一般