1、选择题 恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)?2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间生成amolA,同时消耗1.5amolB;
③各组分的浓度不再变化;
④混合气体的密度不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦混合气体的平均摩尔质量不再变化;
⑧A、B、C的分子数目比为2:3:2.
A.⑤⑥⑧
B.②⑤⑧
C.①③④
D.②④⑦
参考答案:①C的生成速率与C的分解速率相等,正逆反应速率相等,达到了化学平衡,故①不可选;
②单位时间生成amol A,代表逆反应速率,同时消耗1.5amol B,代表正反应速率,且物质的量的变化之比等于化学计量数之比,因此逆反应和正反应速率相等,达到了化学平衡,故②不可选;
③A、B、C的浓度不再变化,达到了平衡状态,故③不可选;
④由于B为固体,因此反应前后气体的质量变化,恒容气体的总体积不变,所以密度变化,因此混合气体的密度不再变化说明达到平衡状态,故④不可选;
⑤应前后气体的化学计量数相等,因此在恒温恒容条件下压强是一定值,混合气体的总压强不再变化不能说明达到平衡状态,故⑤可选;
⑥反应前后气体的化学计量数相等,对于气体物质而言此反应属于等物质的量的反应,因此混合气体的物质的量不再变化不能说明达到平衡状态,故⑥可选;
⑦反应前后气体的化学计量数相等,物质的量不变,由于B为固体,因此反应前后气体的质量变化,因此混合气体的平均摩尔质量为以变化的值,当混合气体的平均摩尔质量不再变化说明达到平衡状态,故⑦不可选;
⑧A、B、C的分子数目比为2:3:2,既不能说明各组分的浓度不再变化,又不能逆反应和正反应速率相等,因此不能说明达到化学平衡状态,故⑧可选;
故选:A.
本题解析:
本题难度:一般
2、填空题 (8分)在25℃时,向100ml含氯化氢14.6g的盐酸溶液里放人5.60g纯铁粉(不考虑反应前后溶液体积变化),反应开始至2min末,收集到1.12L(标准状况)氢气。在此之后,又经过4min,铁粉完全溶解。则:
(1)在前2min内用FeCl2表示的平均化学反应速率是_______
(2)在后4min内用HCl表示的平均化学反应速率是_______
(3)前2min与后4min相比,反应速率较快的是 ________,其原因是_____
参考答案:0.25 mol/L·min? 0.25 mol/L·min?前两分钟,前两分钟盐酸浓度较大
本题解析:涉及反应:Fe+2HCl=FeCl2+H2↑
铁粉的物质的量为 ,2min末,得到氢气
,2min末,得到氢气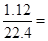 0.05mol
0.05mol
(1)前2min内生成FeCl2的物质的量为0.05mol, 0.25 mol/L
0.25 mol/L
(2)后4min内,溶解的铁为0.1mol—0.05mol=0.05mol,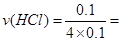 0.25 mol/L
0.25 mol/L
(3)根据方程式系数比可知后4min内,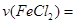 0.125 mol/L,即前2min内反应速率快,主要是由于前两分钟盐酸浓度较大
0.125 mol/L,即前2min内反应速率快,主要是由于前两分钟盐酸浓度较大
本题难度:一般
3、选择题 将0.1mol?N2O4置于1L密闭烧瓶中,然后将烧瓶放入100℃的恒温槽,烧瓶内的气体逐渐变为红棕色:N2O4(g)(无色)═2NO2(g)(红棕色)下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )
A.烧瓶内气体的颜色不变,不再加深
B.N2O4的消耗速率与NO2的生成速率之比为1:2
C.NO2的生成速率与NO2的消耗速率相等
D.NO2的物质的量浓度不变
参考答案:A.该反应中,NO2为红棕色气体,容器内气体的颜色不变,说明浓度不变,反应达到平衡状态,故A正确;
B.无论是否达到平衡状态,都存在N2O4的消耗速率与NO2的生成速率之比为1:2,不能说明正逆反应速率相等,故B错误;
C.NO2的生成速率与NO2的消耗速率相等,说明正逆反应速率相等,达到平衡状态,故C正确;
D.NO2的物质的量浓度不变,反应达到平衡状态,故D正确.
故选B.
本题解析:
本题难度:简单
4、选择题 在一定的温度下,可逆反应A(g)+3B(g)

?2C(g)?达到平衡的标志是( )
A.单位时间生成nmolA,同时生成nmolC
B.A、B、C的分子数之比为1:3:2
C.单位时间生成nmolA,同时生成3nmolB
D.A、B、C的浓度不再变化
参考答案:A.对可逆反应A(g)+3B(g)

2C(g)来说,单位时间生成nmolA,同时生成2nmolC可以表示该反应的正逆反应速率才是相等的,故A错误;
B、A、B、C的分子数比为1:3:2,只是说明A、B、C的分子数之比等于化学计量数之比,不它仅能代表化学平衡状态的某种特殊情况,对判断一个可逆反应是否建立化学平衡没有普遍意义,故B错误;
B.生成A和生成B都代表逆反应速率.单位时间生成nmolA,同时生成3nmolB,只是说明了逆反应按照计量数生成A、B而已,不能说明正反应速率与逆反应速率相等,故C错误;
C.根据化学平衡的定义,可逆反应达到化学平衡状态时,反应物的浓度与生成物的浓度不再发生变化,因此可用“A、B、C的浓度不再变化”来判断该反应达到化学平衡状态,故D正确.
故选D.
本题解析:
本题难度:简单
5、选择题 下列对熵的理解不正确的是
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵值越大
C.与外界隔离的体系,自发过程将导致体系的熵减小
D.25 ℃、1.01×105 Pa时,2N2O5(g)====4NO2(g)+O2(g)是熵增的反应
参考答案:C
本题解析:在与外界隔离的体系中,自发过程将导致体系的熵增大即熵变大于零。
本题难度:简单