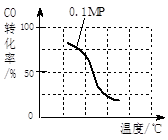1、选择题 在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)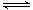 xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器
| 甲
| 乙
| 丙
|
反应物投入量
| 3 mol A、2 mol B
| 6 mol A、4 mol B
| 2 mol C
|
到达平衡的时间(min)
| 5
| ?
| 8
|
A的浓度(mol/L)
| c1
| c2
| ?
|
C的体积分数
| w1
| ?
| w3
|
混合气体密度(g/L)
| ρ1
| ρ2
| ?
|
下列说法正确的是
A.若x<4,则2c1>c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
参考答案:AC
本题解析:若x=4,则容器乙相当于增大压强,平衡不移动,平衡时A的浓度乙是甲的2倍。若x<4,平衡向正反应方向移动,则则2c1>c2,选项A正确。甲和丙属于等效平衡,无论x是否是4,w3=w1,B不正确。密度是混合气的质量和容器容积的比值,所以C正确。D中由于无法确定平衡时A的物质的量,所以无法计算反应速率,D不正确。答案选AC。
本题难度:一般
2、选择题 可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )
①一个N≡N断裂的同时,有3个H-H键断裂;
②一个N≡N键断裂的同时,有6个N-H键断裂;
③其他条件不变时,混合气体平均相对分子质量不再改变;
④保持其他条件不变时,体系压强不再改变;
⑤NH3%、N2%、H2%都不再改变;
⑥恒温恒容时,密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L?min),逆反应速率v(NH3)=0.4mol/(L?min)
A.全部
B.②③④⑤⑥⑦
C.②③④⑤⑦
D.③④⑤⑥⑦
参考答案:①无论是否达到平衡状态,只要一个N≡N断裂的同时,就有3个H-H键断裂,所以不能证明该反应达到平衡状态,故错误;
②反应达到平衡状态时,只要一个N≡N键断裂的同时,就有有6个N-H键断裂,所以能证明该反应达到平衡状态,故正确;
③该反应达到平衡状态时,气体总物质的量不变,气体混合物的质量不变,所以其他条件不变时,混合气体平均相对分子质量不再改变,能说明该反应达到平衡状态,故正确;
④该反应是一个气体体积改变的反应,当反应达到平衡状态时,各物质的浓度不变,则其压强也不变,所以保持其他条件不变时,体系压强不再改变,能说明该反应达到平衡状态,故正确;
⑤反应达到平衡状态时,各物质的百分含量不变,所以NH3%、N2%、H2%都不再改变能证明说明该反应达到平衡状态,故正确;
⑥恒温恒容时,密度始终保持不变,所以不能证明该反应达到平衡状态,故错误;
⑦v正(H2)表示消耗H2的速率,v逆(NH3)表示消耗NH3的速率,且v正(H2):v逆(NH3)=3:2,充分说明向两个相反方向进行的程度相当,说明到达平衡状态,故正确;
故选C.
本题解析:
本题难度:一般
3、选择题 一定条件下,将物质的量之比为1:2的NH3与O2置于恒容的密闭容器中发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列不能说明反应达到平衡状态的是( )
A.NH3的消耗速率等于NH3的生成速率
B.混合气体的密度保持不变
C.NO的物质的量保持不变
D.NH3和O2的浓度不再变化
参考答案:A、NH3的消耗速率等于NH3的生成速率说明正逆反应速率相等,能说明反应达到平衡,故A不符合;
B、无论反应是否达到平衡状态,容器内气体的密度都不发生变化,不能判断是否达到平衡状态,故B符合;
C、NO的物质的量保持不变说明反应达到平衡,故C不符合;
D、NH3和O2的浓度不再变化说明反应达到平衡,故D不符合;
故选B.
本题解析:
本题难度:简单
4、填空题 (13分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g)?ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g)?ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=??;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: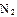 +3
+3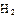
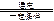 ?2
?2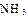 ,则在电化学合成氨的过程中,阴极反应式为_________;
,则在电化学合成氨的过程中,阴极反应式为_________;
?(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为?;
②右图中在状态A时,平衡常数 KA?(填写代入数值
的表达式,不要求算出具体数值);当温度由T1变化到T2时,
?KA ??KB(填“>”、“<”或“=”)。

③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:

反应从0 min到3 min之间,H2的反应速率为?;反应在3 min时,条件发生了改变,改变的条件可能是??(填序号)。
a.使用催化剂? b.降低温度? c.增加H2的浓度
参考答案:(1)-1160 kJ·mol-1 (2分)
(2)N2+6H++6e- =2NH3 (2分)
(3)①40%(2分)
②  (2分, 无单位不扣分,写单位但写错扣1分)? >(1分)
(2分, 无单位不扣分,写单位但写错扣1分)? >(1分)
③0.08 mol·L-1·min-1(2分,单位错扣1分);a(2分)
本题解析:略
本题难度:一般
5、填空题 甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和II,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) 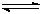 ?CO(g)+3H2 (g)……I? CO(g)+2H2(g)?
?CO(g)+3H2 (g)……I? CO(g)+2H2(g)?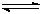 CH3OH(g) ……II。
CH3OH(g) ……II。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。
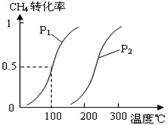
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____________________。
②图中的P1_________P2(填“<”、“>”或“=”),100℃时平衡常数的值为__________?。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a?mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H?____?0;若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2