1、选择题 可逆反应2SO2+O2?2SO3在恒温恒容下进行,能说明反应达到平衡的是( )
A.单位时间内消耗nmolSO2,同时生成nmolSO3
B.v逆(SO3)=2v正(O2)
C.容器内气体的密度保持不变
D.v(SO2)=v(SO3)
参考答案:A、单位时间内消耗n molSO2,同时生成n molSO3,表示的是正逆反应速率,但是不满足二者的化学计量数关系,说明正逆反应速率不相等,没有达到平衡状态,故A错误;
B、v逆(SO3)=2v正(O2),正逆反应速率相等,该反应达到了平衡状态,故B正确;
C、容器容积不变,气体的体积不变,反应两边都是气体,气体的总质量不变,根据ρ=mV,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故C错误;
D、v(SO2)=v(SO3),二者化学计量数相等,反应速率始终相等,无法判断正逆反应速率是否相等,故D错误;
故选B.
本题解析:
本题难度:一般
2、填空题 在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
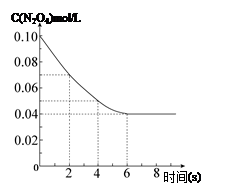
(1)计算在2s至4s时间内,NO2的平均生成速率为?。(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,二氧化氮的起始浓度是?mol·L-1。
(3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于?。化学平衡常数为?。
(4)若在7s时向该密闭容器中再充入0.10 mol N2O4气体,此时平衡向?方向移动(填“正”或“逆”);再次达平衡时,总计0.20 mol N2O4的转化率为α2,正确的是? (? )
A.α2<α1? B.α2>α1? C.α2=α1? D.无法判断。
(5)下表是不同温度下测定的该反应的化学平衡常数。
?
据此判断该反应正反应是?反应(填“吸热”或“放热”)
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是? (? )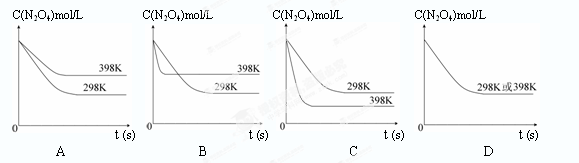
参考答案:
本题解析:(1)由图像可知2s至4s时间内N2O4的浓度变化为0.02 mol/L,根据v=△c/△t结合反应速率之比等于化学计量数之比计算可得,注意写清单位;
(2)对于一定条件下的可逆反应,无论反应从正向开始还是从逆向开始,只要最初加入的物质的量相当,就会达到同一平衡状态。由图像可知c(N2O4)的初始浓度为0.10mol/L,要达到同样的平衡状态,二氧化氮的起始浓度是0.20mol·L-1
(3)根据N2O4的起始浓度和转化浓度求出转化率;根据N2O4和NO2的平衡浓度和平衡常数表达式求平衡常数;
(4)对于一定条件下的可逆反应N2O4(g) 2NO2(g)达平衡后再充入0.10 mol N2O4气体,增大了反应物浓度平衡向正向移动;再加入N2O4后,平衡状态相当于增大压强,平衡左移,N2O4的转化率减小;
2NO2(g)达平衡后再充入0.10 mol N2O4气体,增大了反应物浓度平衡向正向移动;再加入N2O4后,平衡状态相当于增大压强,平衡左移,N2O4的转化率减小;
(5)由表中数据可知,温度升高,平衡常数增大,则说明升高温度,平衡向正反应方向移动,则正反应为吸热反应;
(6)可逆反应N2O4(g) 2NO2(g) 正反应为吸热反应,升温平衡向正向移动,N2O4的平衡浓度减小,升温反应速率加快,可缩短达平衡的时间,结合图像选C。
2NO2(g) 正反应为吸热反应,升温平衡向正向移动,N2O4的平衡浓度减小,升温反应速率加快,可缩短达平衡的时间,结合图像选C。
本题难度:困难
3、选择题 在一定温度下体积固定的密闭容器中,当下列物理量:
①混合气体的压强
②气体的总物质的量
③混合气体的密度
④B的物质的量浓度不再变化时,能表明可逆反应A(s)+2B(g) C(g)+D(g)
C(g)+D(g)
已达平衡的是
[? ]
A.①②
B.①④
C.③④
D.只有④
参考答案:C
本题解析:
本题难度:一般
4、填空题 在容积为1 L的密闭容器中,进行如下反应: A(g)+2B(g) 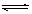 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
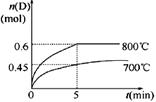
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变? B.混合气体中c(A)不变
C.v正(B)=2v逆(D)? D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=___?_______,该反应为__________反应(填“吸热”或“放热”)。
(4) 800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应______?____(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
参考答案:(1)0.18 mol/(L·min)?(2)ABC?(3)0.9?吸热
(4)向正方向进行
本题解析:(1)700℃时.0-5min内,D的平均化学反应速率v(D)=△n/(V?△t)=0.45mol/(1L×5min)
=0.09mol/(L?min),同一反应中,各物质的反应速率之比等于计量数之比,所以v(B):v(D)=2:1,
故v(B)=0.18mol?L-1?min-1;
(2)该反应是反应前后气体体积减小的反应,反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;所以:
A:该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故A正确;
B:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,B正确;
C:v正(B)=2v逆(D),速率之比等于化学计量数之比,反应达平衡状态,故C正确;
D:无论反应是否达到平衡状态,c(A)=c(C),所以不能作为判断平衡状态的依据,故D错误;
(3)? A(g)+2B(g) C(g)+D(g)
C(g)+D(g)
起始(mol/L) ?1.0?2.2? 0? 0
反应(mol/L)? 0.6? 1.2?0.6? 0.6?
平衡(mol/L) ?0.4 ?1.0? 0.6? 0.6
化学平衡常数K=(0.6mol/L×0.6mol/L)/[0.4mol/L×(1.0mol/L)2 ]=0.9(mol?L-1)-1;
根据图象知,降低温度D的含量减少,所以平衡向逆反应方向移动,故正反应是吸热反应。
(4)A、B、C、D各物质的浓度分别为c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,浓度商QC="(0.2" mol/L×0.018 mol/L)/[0.06 mol/L×(0.5 mol/L)2 ]=0.24(mol?L-1)-1<0.9(mol?L-1)-1,所以反应向正反应方向进行。
本题难度:一般
5、选择题 已知反应2D+E 3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是
3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是

A.pH=6.8时,D的浓度(mg/L)一定最大
B.在pH相同的条件下,增大压强,D的浓度(mg/L)增大
C.调节pH到8.8,可使该反应正、逆反应速率都为0
D.温度相同时,不同pH条件下,该反应的平衡常数相同
参考答案:D
本题解析: A、各pH条件下, 不同时刻,D的浓度不同,pH为6.8时,不一定D的浓度就最大,错误;B、该反应中各物质的状态未知,增大压强,平衡不一定是逆向移动,错误;C、按图像所示,调节pH到8.8时,D的浓度不发生明显变化,但此时可能是平衡状态,正逆反应速率相等,但不为0,错误;D、温度相同,其他条件不同,同一可逆反应的平衡常数相同,正确。
本题难度:一般