1、选择题 对于氧化还原反应8Fe(NO3)2+10HNO3=8Fe(NO3)3+NH4NO3+3H2O,以下叙述错误的是?(?)
A.还原产物为NH4NO3
B.氧化剂与还原剂的物质的量之比为8:1
C.若有1 mol NO3-参加还原反应,则转移8mol电子
D.若应用该反应设计原电池,原电池的负极反应可表示为Fe2+-e-=Fe3+
参考答案:B
本题解析:略
本题难度:简单
2、填空题 配平下列离子方程式,并用双线桥法表示电子转移的关系:
MnO4-+SO32-+H+-------Mn2++SO42-+H2O
参考答案: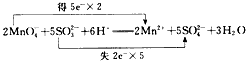
本题解析:
本题难度:一般
3、填空题 电解饱和食盐水的反应为2NaCl+2H2O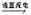 Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是 。阴极产物之一为H2,阴极上发生的变化为 反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2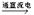 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe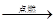 2FeCl3
2FeCl3
参考答案:27. 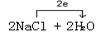 (2分,方向、数目各1分)
(2分,方向、数目各1分)
28. Cl(1分) 还原(1分)
29. a、d(2分、选对1个得1分,错选、多选不得分)
本题解析:27.方程式中Cl从-1→0,失去电子,H从+1→0得到电子,故电子转移的方向Cl→H,数目2e-。
28.反应过程中化合价升高的元素被氧化,该反应中被氧化的元素是Cl。阴极产物之一为H2,H元素化合价降低,阴极上发生的变化为还原反应。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。
a.Cl2+2KI→2KCl+I2,Cl的化合价只降低,Cl2是氧化剂;b.Cl2 + 2NaOH →NaCl + NaClO + H2O Cl的化合价既升高又降低,Cl2既是氧化剂又作还原剂;c.CuCl2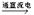 Cl2↑+ Cu,Cl的化合价只升高,Cl2是还原;d.3Cl2 + 2Fe
Cl2↑+ Cu,Cl的化合价只升高,Cl2是还原;d.3Cl2 + 2Fe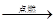 2FeCl3,Cl的化合价只降低,Cl2是氧化剂。
2FeCl3,Cl的化合价只降低,Cl2是氧化剂。
考点:氧化还原反应的基本概念。
本题难度:一般
4、选择题 单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH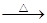 2 K2S + K2SO3 + 3 H2O
2 K2S + K2SO3 + 3 H2O
若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。则以下正确的是
A.a = 2b
B.x = 2
C.n = 0.48
D.b = 0.02
参考答案:AC
本题解析:根据3 S + 6 KOH 2 K2S + K2SO3 + 3 H2O反应,将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应,硫剩余0.05 mol,生成0.02mol K2S和0.01molK2SO3 ,恰好生成a mol K2Sx和b mol K2S2O3,由钾元素守恒:2a+2b=0.06,由硫元素守恒:ax+2b=0.08。再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。由电子守恒:ax(6+2/x)+2b(6-2)=n。另外相当于失电子的全是0.08 mol单质硫,故有n="0.08" mol*6=0.48mol。联立三个关系式解得:x=3,a=0.02,b=0.01分别把选项代入验证,可知AC满足。
2 K2S + K2SO3 + 3 H2O反应,将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应,硫剩余0.05 mol,生成0.02mol K2S和0.01molK2SO3 ,恰好生成a mol K2Sx和b mol K2S2O3,由钾元素守恒:2a+2b=0.06,由硫元素守恒:ax+2b=0.08。再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。由电子守恒:ax(6+2/x)+2b(6-2)=n。另外相当于失电子的全是0.08 mol单质硫,故有n="0.08" mol*6=0.48mol。联立三个关系式解得:x=3,a=0.02,b=0.01分别把选项代入验证,可知AC满足。
本题难度:一般
5、选择题 下图标出了各种材料强度与密度的比值以及广泛使用的年代。
(1)从图中可以看出的信息有
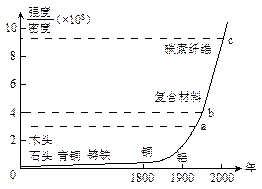
A.科学技术的发展越来越快,新材料频频出现? B.新材料发展的总体趋势是强度越来越大
C.1800年以前出现的材料强度都比铝小? D.铝的密度比钢的密度大
(2)有甲、乙两种材料,它们的强度相同,甲的密度是乙的2倍。且甲材料在图中的b点对应,则乙材料在图的位置是
A.a点? B.a、b之间? C.c点? D.b、c之间
参考答案:(1)A?(2)D
本题解析:(1)从上图中可以非常清楚看出:随着科学技术的发展越来越快,新材料频频出现,A是正确的。新材料发展的总体趋势并不是简单的强度越来越大,如铝的强度就不比铁的高,B、C都是错误的。根据常识可知,铝的密度应该比钢的密度小(铝属于轻金属,而钢属于重金属),D错误。(2)经过简单运算,因为甲的密度是乙的2倍,其强度与密度的比值是乙的1/2,即乙对应的纵坐标应该是8。
本题难度:简单