1、选择题 对于氧化还原反应8Fe(NO3)2+10HNO3=8Fe(NO3)3+NH4NO3+3H2O,以下叙述错误的是?(?)
A.还原产物为NH4NO3
B.氧化剂与还原剂的物质的量之比为8:1
C.若有1 mol NO3-参加还原反应,则转移8mol电子
D.若应用该反应设计原电池,原电池的负极反应可表示为Fe2+-e-=Fe3+
2、填空题 配平下列离子方程式,并用双线桥法表示电子转移的关系:
MnO4-+SO32-+H+-------Mn2++SO42-+H2O
3、填空题 电解饱和食盐水的反应为2NaCl+2H2O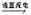 Cl2↑+H2↑+2NaO H。
Cl2↑+H2↑+2NaO H。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是 。阴极产物之一为H2,阴极上发生的变化为 反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2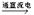 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe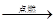 2FeCl3
2FeCl3
4、选择题 单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH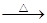 2 K2S + K2SO3 + 3 H2O
2 K2S + K2SO3 + 3 H2O
若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。则以下正确的是
A.a = 2b
B.x = 2
C.n = 0.48
D.b = 0.02
5、选择题 下图标出了各种材料强度与密度的比值以及广泛使用的年代。
(1)从图中可以看出的信息有
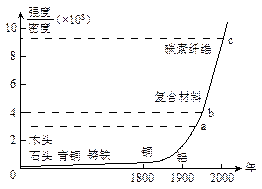
A.科学技术的发展越来越快,新材料频频出现? B.新材料发展的总体趋势是强度越来越大
C.1800年以前出现的材料强度都比铝小? D.铝的密度比钢的密度大
(2)有甲、乙两种材料,它们的强度相同,甲的密度是乙的2倍。且甲材料在图中的b点对应,则乙材料在图的位置是
A.a点? B.a、b之间? C.c点? D.b、c之间