1、填空题 某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
参考答案:(1)否 (1分)CaHCl (2分)
(2)2CaHCl + 2H2O = CaCl2 + Ca(OH)2 + 2H2↑(2分)
取样,加稀HNO3溶解后分成二等份,其中一份加入Na2CO3溶液,得到CaCO3沉淀,称重后求得n(Ca2+);另一份加入AgNO3溶液,得到AgCl沉淀,称重后求得n(Cl-), 用下式即可求得x值: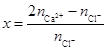 (3分,其它合理答案也给分)
(3分,其它合理答案也给分)
(3)2Cl- + MnO2 + 4H+= Mn2+ + Cl2↑+ 2H2O (2分)
保持FeCl2溶液呈酸性,并加入铁粉防止氧化 (2分)
(4)Ca + CaCl2 = 2CaCl
本题解析:(1)化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%,加起来比100%小,表明该物质中还含有氢元素,其质量分数为:100%-52.36%-46.33%=1.31%。因此,可以来确定甲这种物质的化学式:
N(Ca)
本题难度:一般
2、填空题 将一支盛有a mL NO 和b mL NO2气体的试管倒立于水槽中,然后通过a mL O2,请回答以下小题:
(1)若a=b,则充分反应后试管内气体体积为_________mL。
(2)若a<b,则充分反应后试管内气体体积为_________mL。
(3)若a>b,则充分反应后试管内气体体积为_________mL。
参考答案:(1)0?(2)(b-a)/3?(3)(a-b)/4
本题解析:NO 和 NO2气体与氧气、水反应涉及到的化学方程式为4NO+3O2+2H2O=4HNO3、4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO
(1)a=b时,NO 和 NO2气体与氧气恰好完全反应,无气体剩余,体积为0;
(2)a<b时,氧气不足,aml的NO需要3a/4ml的氧气,a/4ml的氧气只能与aml的NO2反应,余(b-a)ml的NO2再与水反应产生(b-a)/3ml的NO;
 (3)a>b时,氧气过量,aml的NO需要3a/4ml的氧气,bml的NO2气体需要b/4ml的氧气,剩余氧气a-3a/4-b/4=(a-b)/4ml。2混合气体与氧气、水反应的计算
(3)a>b时,氧气过量,aml的NO需要3a/4ml的氧气,bml的NO2气体需要b/4ml的氧气,剩余氧气a-3a/4-b/4=(a-b)/4ml。2混合气体与氧气、水反应的计算
本题难度:一般
3、选择题 某温度下,将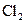 通入
通入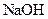 溶液中,生成
溶液中,生成 、
、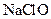 、
、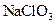 的混合液,若此反应中被还原的氯原子与被氧化的氯原子的物质的量之比为7:2,则生成的ClO-与ClO
的混合液,若此反应中被还原的氯原子与被氧化的氯原子的物质的量之比为7:2,则生成的ClO-与ClO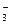 的物质的量浓度之比为(?)
的物质的量浓度之比为(?)
A.4:1
B.3:2
C.1:1
D.3:5
参考答案:D
本题解析:略
本题难度:简单
4、选择题 从2mol?L-1的氯化铜溶液中取出含Cl-为3.55g的溶液,所取溶液的体积是( )
A.50mL
B.25mL
C.12.5mL
D.0.025mL
参考答案:设所取溶液的体积为V,Cl-为3.55g的氯化铜溶液中氯离子的浓度=3.55g35.5g/molV=2×2mol?L-1,解得V=0.025L,即V=25mL.
故选B.
本题解析:
本题难度:一般
5、计算题 (8分)将一定质量的Mg-Al合金投入500 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加 5 mol· L-1 NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如下图所示。
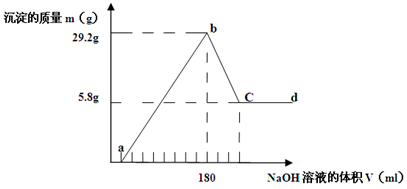
求: (1)原合金中Mg、Al质量各多少克? Mg?g , Al?g。
(2)b-c段反应的离子方程式为?
(3) HCl物质的量浓度?mol/L
参考答案:(1)2.4g? 8.1g (2)Al(OH)3+OH-=AlO2-+2H2O?(3)1.8
本题解析:向溶液中滴加NaOH溶液过程中所涉及反应为:
①H++OH-=H2O?②Mg2++2OH-=Mg(OH)2?③ Al3++3OH-=Al(OH)3
③Al(OH)3+OH-=AlO2-+2H2O
(1)由Mg~Mg(OH)2可知铝粉的质量为: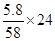 =2.4 g
=2.4 g
Al~Al(OH)3可知铝粉质量为: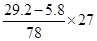 =8.1g
=8.1g
(2)在b点时溶液呈中性,酸提供的氢离子与碱提供的氢氧根离子的物质的量相等,则盐酸的物质的量浓度为:c(HCl)×0.5=0.18×5,即c(HCl)=1.8 mol/L
本题难度:一般