1、选择题 过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等。现向50mL浓度为0.100 mol/L的FeCl2溶液中加入25mL浓度为0.0400 mol/L的KMnO4,在滴加少量的H2SO4后,两者恰好完全反应。则氧化剂KMnO4的还原产物可能为
[? ]
A.K2MnO4
B.MnO2
C.MnCl2
D.Mn
参考答案:C
本题解析:解析:
n(FeCl2)=0.05L×0.1mol/L=0.005mol,反应后被氧化生成Fe3+,Fe元素化合价升高1价,
n(KMnO4)=0.025L×0.04mol/L=0.001mol,设被还原后Mn元素的化合价为+x,则由电子守恒有
0.005mol×(3-2)=0.001mol×(7-x),解得x=2,
故选:C.
本题难度:一般
2、填空题 (8分)氰(CN)2?的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2?和水反应可生成HCN和HCNO;(CN)2?的氧化性比Br2弱,比I2强。
(1)下列有关反应方程式不正确的是?(填选项标号)。
A.(CN)2?和NaOH溶液反应:(CN)2? + 2OH-= CN-+ CNO-+ H2O
B.MnO2和HCN反应:MnO2 + 4HCN  ?Mn(CN)2 + (CN)2?↑ + 2H2O
?Mn(CN)2 + (CN)2?↑ + 2H2O
C.向KCN溶液中加入碘水:I2 + 2KCN =" 2KI" + (CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2 + 2Br-= 2Cl-+ Br2
(2)HCN的电子式为?。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为?(填选项标号)。
A.1? B.1/2 ? C.2 ? D.不能确定
②若d=e=1,则b=?。
参考答案:(1)CD;?(2)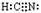 ;?(3)①B;? ②6
;?(3)①B;? ②6
本题解析:(1)根据(CN)2与水反应生成HCN和HCNO,可知(CN)2与NaOH溶液反应为(CN)2? + 2OH-= CN-+ CNO-+ H2O,A正确,根据氧化性Cl2>Br2>(CN)2>I2,可知MnO2和HCN能反应生成(CN)2?:MnO2 + 4HCN  ?Mn(CN)2+ (CN)2?↑ + 2H2O,B项正确,C、D项错误。
?Mn(CN)2+ (CN)2?↑ + 2H2O,B项正确,C、D项错误。
(2)HCN的电子式为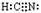 。
。
(3)根据原子守恒可知e:f=1:2。根据电荷守恒和原子守恒可知当d=e=1时,a=2,b=6,c=1,f=2。
点评:本题主要根据氧化性强弱、守恒法进行判断。
本题难度:一般
3、选择题 元素从化合态变为游离态,则该元素? ?(?)
?(?)
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.既不被氧化,也不被还原
参考答案:C
本题解析:略
本题难度:简单
4、选择题 常温下,将等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体,该晶体是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2·6H2O Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
A.1 mol摩尔盐强热分解时转移电子的物质的量为8NA
B.该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3
C.向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和白色沉淀
D.常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小
参考答案:D
本题解析:根据元素化合价的变化可知,氮元素的化合价从-3价升高到0价,因此氮气是氧化产物,但氨气不是。铁的化合价从+2价升高到+3价,因此氧化铁是氧化产物,A不正确。S的化合价从+6价降低到+4价,转移2个电子,因此1 mol摩尔盐强热分解时转移电子的物质的量为4NA,B不正确。C不正确,沉淀应该是氢氧化铁,是红褐色的。等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体,说明常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小,D正确,答案选D。
本题难度:一般
5、计算题 (8分)将10g铁置于40 mL某浓度的硝酸中,再微热充分反应后,共收集到NO,NO2混合气体1792 mL,溶液里还残留4.4g固体(标准状况)。求:
(1)NO的体积为?mL,NO2的体积为?mL。
(2)则原硝酸溶液的浓度为?mol/L。
(3)欲使铁与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要质量分数为30%的双氧水? _g。(保留一位小数)
参考答案:(1)1344, (2分)448(2分)? (2)7 mol/L(2分)? (3)11.3(2分)
本题解析:(1)溶液中残留固体,说明铁是过量的,因此溶液中生成的是硝酸亚铁,参加反应的铁是10g-4.4g=5.6g,物质的量是0.1mol,失去电子是0.2mol,NO、NO2混合气体是
 。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。
。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。
(2)硝酸亚铁是0.1mol,根据原子守恒可知原硝酸的物质的量是0.1mol×2+0.08mol=0.28mol,
其浓度是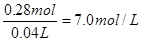 。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至
。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至
少需要质量分数为30%的双氧水是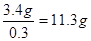 。
。
本题难度:一般