| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《盐类水解的原理》考点强化练习(2017年押题版)(四)
参考答案: 本题解析:A、玻璃中的二氧化硅和氢氟酸反应,不能用玻璃容器盛放氢氟酸,故A错误;B、纯碱为碳酸钠,溶液中碳酸根离子水解显碱性,油脂在碱溶液中水解生成溶于水的物质,纯碱可用于清洗油污,故B正确;C、浓氨水挥发出的氨气和氯气发生氧化还原反应生成氮气和氯化铵,3Cl2+8NH3=N2+6NH4Cl,反应过程中现象是冒白烟,浓氨水可检验氯气管道漏气,故C正确;D、浓硫酸能与氨气反应生成硫酸铵,不能除去氨气中的水蒸气,故D错误,故选AD。 本题难度:一般 2、选择题 下列溶液中微粒的物质的量浓度关系正确的是 |
参考答案:C
本题解析:A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液,根据电荷守恒可得:c(H+)+ c(NH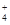 )= c(OH-)+c(Cl-),由于溶液的pH=7,所以c(H+)= c(OH-),但是盐是强电解质,电离程度远大于弱电解质水的电离,所以c(H+)= c(OH-)<c(NH4+)=c(Cl-),错误;B.0.1mol/LNa2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C.25℃时,HCOOH是弱酸,部分电离,在溶液中存在电离平衡,HCOOH的pH=2,则c(HCOOH)>10-2mol/L,NaOH是强碱,完全电离,c(NaOH)=10-2mol/L。当二者等体积混合时,n(HCOOH)>n(NaOH)。溶液是HCOONa和HCOOH的混合溶液。由于溶液显酸性,c(H+)> c(OH-),HCOOH的电离作用大于HCOONa的水解作用,所以c (HCOO-)> c(Na+),所以c (HCOO-)+ c(H+)>c(Na+)+c(OH-),正确;D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒,可得:3c(CO32-) +3c(HCO3-)+3c(H2CO3)=2c(Na+)。
)= c(OH-)+c(Cl-),由于溶液的pH=7,所以c(H+)= c(OH-),但是盐是强电解质,电离程度远大于弱电解质水的电离,所以c(H+)= c(OH-)<c(NH4+)=c(Cl-),错误;B.0.1mol/LNa2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C.25℃时,HCOOH是弱酸,部分电离,在溶液中存在电离平衡,HCOOH的pH=2,则c(HCOOH)>10-2mol/L,NaOH是强碱,完全电离,c(NaOH)=10-2mol/L。当二者等体积混合时,n(HCOOH)>n(NaOH)。溶液是HCOONa和HCOOH的混合溶液。由于溶液显酸性,c(H+)> c(OH-),HCOOH的电离作用大于HCOONa的水解作用,所以c (HCOO-)> c(Na+),所以c (HCOO-)+ c(H+)>c(Na+)+c(OH-),正确;D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒,可得:3c(CO32-) +3c(HCO3-)+3c(H2CO3)=2c(Na+)。
考点:考查微粒的物质的量浓度关系正误判断的知识。
本题难度:困难
3、填空题 工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1mol O2发生反应,则下列说法正确的是 。
A.若反应速率v (SO2)
参考答案:
本题解析:
本题难度:困难
4、选择题 室温下,下列变化后的溶液pH小于8的是
A.pH=10的氨水稀释100倍
B.pH=11的NaOH溶液与pH=5的盐酸等体积混合
C.pH=8的NaOH溶液与pH=8的氨水等体积混合
D.pH=4的醋酸和pH=10的NaOH溶液等体积混合
参考答案:D
本题解析:pH=10的氨水稀释100倍,由于是弱碱,故pH>8,A错误;pH=11的NaOH溶液与pH=5的盐酸等体积混合,氢氧化钠是过量的,混合液中OH-的浓度为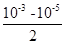 =5x10-4mol/L,B错误;C中均是强碱,混合后pH不变,C错误;pH=4的醋酸和pH=10的NaOH等体积混合,醋酸过量,溶液显酸性,D正确,答案选D.
=5x10-4mol/L,B错误;C中均是强碱,混合后pH不变,C错误;pH=4的醋酸和pH=10的NaOH等体积混合,醋酸过量,溶液显酸性,D正确,答案选D.
考点:pH计算
本题难度:一般
5、选择题 常温下,0.1mol·L-1CH3COONa溶液中,微粒浓度间关系正确的是
A.c(Na+)=c(CH3COO-) >c(OH-)=c(H+)
B.c(OH-)=c(H+)+ c(CH3COOH)
C.c(Na+) + c(H+)= c(CH3COO-) +c(OH-)
D.c(CH3COOH) + c(CH3COO-) = c(Na+)+ c(H+)
参考答案:BC
本题解析:A项由于CH3COO-发生水解使溶液显碱性,错误;B项满足CH3COONa溶液的质子守恒,正确;C项满足CH3COONa溶液的电荷守恒,正确;D项不满足CH3COONa溶液的物料守恒,错误。
考点:考查电解质溶液中的三大守恒及微粒浓度大小关系。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质结构和.. | |