|
|
|
高中化学知识点归纳《盐类水解的原理》考点强化练习(2017年押题版)(七)
2017-11-11 01:28:35
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 在0.1mol/L的NH4HSO4溶液中,下列微粒的物质的量浓度关系正确的是
A.c(H+) = c(SO42-) > c(NH4+)
B.c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-)
C.c(H+) = c(NH4+) + c(NH3?H2O) + c(OH-)
D.室温下滴加NaOH溶液至中性后:c(Na+) > c(SO42-) > c(NH4+) > c(OH-) = c(H+)
|
2、填空题 (20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
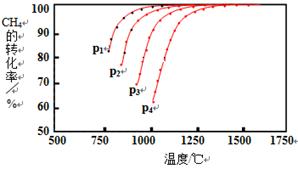
则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
3、选择题 下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生现象剧烈的反应
B.Al、Al2O3、Al(OH)3、NaAlO2均能和NaOH溶液发生反应
C.NaHCO3可用于制备纯碱、治疗胃酸过多的药剂、食品发酵剂
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
|
4、选择题 下列事实所对应的方程式不正确的是
A.用Na2S除去废水中的Hg2+:Hg2+ +S2- ="==" HgS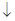
B.纯碱溶液能清洗油污:
C.氨气遇氯化氢时产生白烟:
D.向海带灰浸出液中加入硫酸、双氧水:2I- +2H+ +H2O2="==" I2 +2H2O
5、选择题 H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol/L NaHSO3溶液中,下列关系正确的是
A.c(HSO3-) > c(SO32-) > c(H2SO3)
B.c(Na+) = c(HSO3-) + 2c(SO32-) + c(HSO3)
C.c(Na+) = c(HSO3-) > c(H+) > c(OH-)
D.c(Na+) + c(H+) = c(HSO3-) + c(OH-) + c(SO32-)