| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《盐类水解的原理》考点强化练习(2017年押题版)(八)
参考答案:BD 本题解析:A、HSO- 4完全电离,NH4+会部分水解产生H+,c(H+) > c(SO42-) > c NH4+),错误;B、根据溶液中电荷守恒,c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-),正确;C、由电荷守恒,c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-),物料守恒:c(NH4+) + c(NH3?H2O)= c(SO42-),可知质子守恒为c(H+) = c(NH4+) + 2c(NH3?H2O) + c(OH-),错误;D、若两者1:1反应得到等浓度硫酸铵和硫酸钠混合溶液,NH4+会部分水解产生H+,此时c(Na+) > c(SO42-) > c(NH4+) > c(H+)>c(OH-),若要显中性,需再滴加NaOH溶液,故c(Na+) > c(SO42-) > c(NH4+) > c(OH-) = c(H+),正确。 本题难度:一般 2、填空题 (20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题: 参考答案:Ⅰ.p4>p3>p2>p1;吸热,1024mol2·L-2; 本题解析:I.由图可知,温度降低,转化率下降,则可知该反应为吸热反应,反应CH4(g)+CO2(g) 本题难度:困难 3、选择题 下列关于元素及其化合物的说法正确的是 |
参考答案:C
本题解析:A、铁在常温下,与浓硝酸、浓硫酸发生钝化,故A错误;B、NaAlO2不能和NaOH溶液发生反应,故B错误;C、NaHCO3可用于制备纯碱、治疗胃酸过多的药剂、食品发酵剂,故C正确;D、FeCl3、CuCl2能发生水解反应,生成易挥发的HCl,使水解平衡不断向右移动,所以制备FeCl3、CuCl2固体不能采用将溶液直接蒸干的方法,故D错误。
考点:本题考查物质的性质与用途、盐类的水解。
本题难度:一般
4、选择题 下列事实所对应的方程式不正确的是
A.用Na2S除去废水中的Hg2+:Hg2+ +S2- ="==" HgS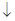
B.纯碱溶液能清洗油污:
C.氨气遇氯化氢时产生白烟:
D.向海带灰浸出液中加入硫酸、双氧水:2I- +2H+ +H2O2="==" I2 +2H2O
参考答案:B
本题解析:A、硫离子与汞离子反应生成硫化汞沉淀,正确;B、碳酸根离子水解是分步进行,离子方程式不能一步写成,错误;C、氨气与氯化氢反应生成氯化铵固体,产生白烟现象,正确;D、海带灰中的碘离子与过氧化氢、氢离子发生氧化还原反应,生成单质碘和水,符合离子方程式的书写,正确,答案选B。
考点:考查离子方程式书写正误的判断
本题难度:一般
5、选择题 H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol/L NaHSO3溶液中,下列关系正确的是
A.c(HSO3-) > c(SO32-) > c(H2SO3)
B.c(Na+) = c(HSO3-) + 2c(SO32-) + c(HSO3)
C.c(Na+) = c(HSO3-) > c(H+) > c(OH-)
D.c(Na+) + c(H+) = c(HSO3-) + c(OH-) + c(SO32-)
参考答案:A
本题解析:NaHSO3溶液呈酸性,表明HSO3-的电离程度大于水解程度,但是电离和水解都比较微弱,所以A对;B项结合物料守恒,应该为c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3);C项应为c(Na+)>c(HSO3-) > c(H+) > c(OH-);结合电荷守恒可知D项错误,应为c(Na+) + c(H+) = c(HSO3-) + c(OH-) +2 c(SO32-).
考点:离子浓度大小的比较。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质结构和.. | |