1、选择题 下列化学用语表达正确的是(?)
A.对硝基甲苯的结构简式: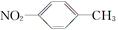
B.CH2F2的电子式: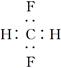
C.16O2与18O2互为同素异形体
D.乙炔的最简式:CH
2、填空题 (3分)工业上冶炼金属铁的主要反应为:Fe2O3 + 3CO? =" 2Fe" + 3CO2。其中,Fe2O3? __________(填“被氧化”或“被还原”),CO作_________(填“氧化剂”或“还原剂”)。在该反应中,若消耗了1 mol Fe2O3,则生成__________mol Fe。
3、简答题 浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下).Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O.试计算:
(1)反应生成硫酸铜的物质的量;
(2)被还原的H2SO4的质量是多少?
4、填空题 (10分)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 ="=" 3Cu(NO3)2 + 2NO↑+ 4H2O
(1)上述反应中氧化剂与氧化产物的物质的量之比 。
(2)若生成NO的体积为3.36L(标准状况),且硝酸足量,则消耗铜的质量 g,转移电子的数目为 ,被还原的硝酸为 mol。
(3)写出该反应的离子方程式 。
5、填空题 为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
水解反应
| 平衡常数(K)
|
Fe3+ + 3H2O  ?Fe(OH)3 + 3H+ ?Fe(OH)3 + 3H+
| 7.9 × 10-4
|
Fe2+ + 2H2O  ?Fe(OH)2 + 2H+ ?Fe(OH)2 + 2H+
| 3.2 × 10-10
|
Cu2+ + 2H2O  ?Cu(OH)2 + 2H+ ?Cu(OH)2 + 2H+
| 3.2 × 10-7
|
?
请回答:(1)稀硝酸和Cu反应的化学方程式为?。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。
方案:?。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
实验内容
| 实验现象
|
甲同学的实验方案
| 溶液逐渐变成蓝绿色, pH略有上升
|
乙同学的实验方案
| 无明显现象,pH没有明显变化。
|
?
①据实验现象写出发生反应的离子方程式:?。
②导致实验过程中溶液pH略有上升的可能原因是?。
③解释乙同学的实验现象?。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:?。