1、选择题 今有下列溶液:AlCl3、FeCl2、FeCl3、MgCl2、NH4Cl、NaCl,用一种试剂就可以鉴别的是.
A.Na2CO3
B.NH3·H2O
C.NaOH
D.HNO3
参考答案:C
本题解析:6种溶液中分别加入NaOH溶液的现象:AlCl3先出现白色沉淀后溶解;FeCl2白色沉淀→灰绿色沉淀→红褐色沉淀;FeCl3红褐色沉淀;MgCl2白色沉淀;NH4Cl产生刺激性气味气体;NaCl无明显现象.
本题难度:简单
2、选择题 H、D、T、H+可以用来表示
A.同一种原子?
B.化学性质不同的氢原子
C.氢元素?
D.氢的四种核素
参考答案:C
本题解析:
本题难度:简单
3、选择题 今有一混合物的水溶液,含有以下离子中的若干种:Na+、NH+4、Cl-、Ba2+、HCO3-、SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
(3)第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测正确的是
A.Na+一定存在
B.100mL该溶液中含0.1mol?HCO-3
C.Ba2+一定存在
D.Cl-一定不存在
参考答案:A
本题解析:分析:1、根据题意分析,第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、SO42-,第二份溶液加足量NaOH溶液加热后收集到气体,推得一定含有NH4+,第三份溶液利用发生的离子反应,经过计算、推得一定存在HCO3-、SO42-,一定不存在Ba2+;2、根据溶液中阴阳离子的电荷守恒,即可推出Na+一定存在,由Na+物质的量的变化分析Cl-的情况.
解答:根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4沉淀,因此两者不能大量共存.Ba2+和CO32-可发生离子反应生成BaCO3沉淀,因此两者也不能大量共存.第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、SO42-.第二份加足量NaOH溶液加热后,收集到气体448mL,即0.02mol,能和NaOH溶液加热产生气体的只能是NH4+,根据反应NH4++OH-=NH3↑+H2O,产生NH3为0.02mol,可得NH4+也为0.02mol.第三份加足量BaCl2溶液后,得干燥沉淀4.30g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应HCO3-+Ba2++OH-═BaCO3↓+H2O、SO42-+Ba2+═BaSO4↓,因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在HCO-、SO42-,一定不存在Ba2+.由条件可知BaSO4为2.33g,物质的量为0.01mol,BaCO3为4.30g-2.33g═1.97g,物质的量为0.01mol,根据原子守恒,所以100mL该溶液中含0.1mol HCO3-,则HCO32-物质的量为0.01mol,物质的量浓度为0.1mol/L,由上述分析可得,溶液中一定存在HCO3-、SO42-、NH4+,其物质的量分别为:0.01mol、0.01mol、0.02mol,根据溶液中电荷守恒,可知Na+一定存在,Na+物质的量≥0.01mol,当K+物质的量>0.01mol时,溶液中还必须含有Cl-,反之,则不存在,
A、根据电荷守恒,钠离子一定存在,故A正确;
B、100mL该溶液中含0.01mol的碳酸氢根离子,故B错误;
C、钡离子一定不存在,故C错误;
D、不能确定氯离子是否存在,故D错误.
故选A.
点评:本题考查离子的检验,采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是钠离子的确定易出现失误.
本题难度:简单
4、选择题 在c(H+):c(OH-)=1:2的水溶液中能大量共存的离子组是
A.K+、Al3+、H2PO4-、SO42-
B.Ca2+、NH4+、CO32-、Cl-
C.Na+、K+、NO3-、ClO-
D.Na+、Ba2+、I-、SO32-
参考答案:C
本题解析:分析:c(H+):c(OH-)=1:2的水溶液中,溶液显碱性,该组离子之间不能结合生成水、气体、沉淀等,则离子之间能共存,以此来解答.
解答:c(H+):c(OH-)=1:2的水溶液中,溶液显碱性,
A.Al3+、H2PO4-都与OH-反应,则不能共存,故A错误;
B.Ca2+、CO32-能结合生成沉淀,则不能共存,故B错误;
C.该组离子之间不反应,与碱液不反应,则能共存,故C正确;
D.因Ba2+、SO32-能结合生成沉淀,则不能共存,故D错误;
故选C.
点评:本题考查离子的共存,熟悉复分解反应发生的条件及离子之间的反应即可解答,题目难度不大.
本题难度:困难
5、选择题 几种短周期元素的原子半径及主要化合价如下表
A.R的氧化物对应的水化物可能具有两性
B.X单质在氧气中燃烧不可能生成XO3
C.离子半径大小:r(M3+)>r(T2-)
D.最高价氧化物对应水化物碱性:L(OH)2>M(OH)3
参考答案:C
本题解析:L、M、X、R、T对应的元素分别为: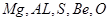 所以
所以
A正确,氢氧化铍具有两性;B正确,S单质燃烧不能生成三氧化硫;C错,离子半径大小关系为:r(T2-)>r(M3+ );D正确;镁的金属性比铝强;
本题难度:困难