1、简答题 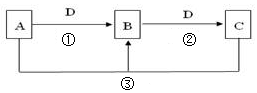
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是?,工业上制取A的离子方程式Ⅰ为?。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 ?。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是?。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式?;
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
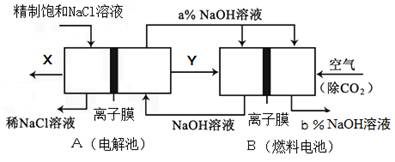
(6)Ⅰ①图中X、Y分别是?(填化学式),分析比较图示中氢氧化钠质量分数a%?b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应?。
参考答案:(1)FeCl3? 2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(2)4NH3+5O2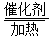 4NO+6H2O
4NO+6H2O
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)2H2S+SO2=3S↓+H2O
(5)① Cl2? H2?>?② H2-2e-+2OH-=2H2O
本题解析:(1)若A可用于自来水消毒,应为Cl2,D是生产、生活中用量最大、用途最广的金属单质,应为Fe,则B为FeCl3,C为FeCl2,工业上制取A的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(2)若A是一种碱性气体,常用作制冷剂,应为NH3,B是汽车尾气之一,遇空气会变色,应为NO,反应①的化学方程式为4NH3+5O2 4NO+6H2O。(3)若D是氯碱工业的主要产品,B有两性,由转化关系D为NaOH,B为Al(OH)3,C为NaAlO2,反应②的离子方程式是Al(OH)3+OH-=AlO2-+2H2O。
4NO+6H2O。(3)若D是氯碱工业的主要产品,B有两性,由转化关系D为NaOH,B为Al(OH)3,C为NaAlO2,反应②的离子方程式是Al(OH)3+OH-=AlO2-+2H2O。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,应为SO2,则A为H2S,D为O2,B为S,反应③的化学方程式是2H2S+SO2=3S↓+H2O
(5)①在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%大于b%;
②燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,电极反应式为H2-2e-+2OH-=2H2O。
本题难度:一般
2、选择题 向盛有Cl2的三个集气瓶甲、乙、丙中各加入下列液体中的一种,经振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是?(?)
①AgNO3溶液?②NaOH溶液?③水
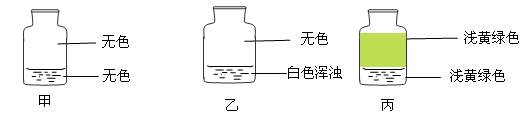
A.①②③
B.②①③
C.③②①
D.①③②
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列关于氯水的叙述中,正确的是
A.新制氯水能使紫色石蕊试液先变红,后褪色
B.氯水光照时有气泡溢出,该气体一定是氯气
C.新制氯水中只有氯气和水分子
D.氯水放置数天后,酸性减弱
参考答案:A
本题解析:A 正确,氯气和水反应生成盐酸和次氯酸,所以显酸性和漂白性,故使紫色石蕊试液先变红,后褪色
B 错误,该气体可能是氧气
C 错误,还有次氯酸分子
D 错误,氯水放置数天后,酸性增强
故选A
本题难度:一般
4、选择题 不能用金属跟氯气直接反应制得的氯化物的是?
A.NaCl
B.MgCl2
C.CuCl2
D.FeCl2
参考答案:D
本题解析:氯气具有强氧化性,和铁反应生成的是氯化铁,答案选D。
点评:本题是基础性试题的考查,知识点属于记忆性的,关键是学生要熟练记住常见元素及其化合物的有关转化。
本题难度:简单
5、选择题 下列说法正确的是( )
A.Cl-和Cl2都属于氯元素
B.Cl2有毒,Cl-也有毒
C.次氯酸中氯元素的化合价为-1
D.Cl2和Cl原子都呈黄色
参考答案:A、元素是指具有相同质子数的同一类原子总称为元素,所以Cl-和Cl2都是由氯元素组成,故A正确;
B、Cl2有毒,Cl-无毒,故B错误;
C、次氯酸中氯元素的化合价为+1价,故C错误;
D、Cl2是黄绿色气体,Cl原子没有色,故D错误;
故选A.
本题解析:
本题难度:一般