1、填空题 A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。
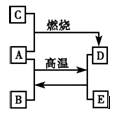
(1)写出A、B、C的化学式:
A___________________;B_________________;C______________。
(2)写出A、B转化为D、E的化学方程式_____________________________________。
(3)写出A与足量稀硝酸反应的离子方程式___________________________________。
参考答案:(1)(1分×3=3分)Fe;H2O;O2
(2)(2分)3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
(3)(2分)Fe+4H++NO3-==Fe3++NO↑+2H2O
本题解析:略
本题难度:简单
2、简答题 研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O.他们设计了如下制取氯气并验证其性质的实验.
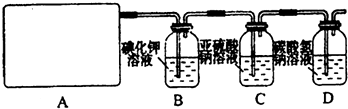
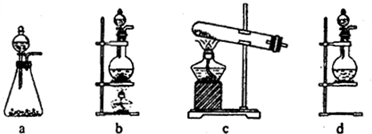
试回答:(1)该实验中A部分的装置是______(填写装置的序号).
(2)(1)选项中d装置的两个主要的玻璃器皿的名称分别是______、______.
(3)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):______.
(4)分别写出C装置、D装置发生反应的离子方程式______.
(5)该实验存在明显的缺陷,请你从化学反应的视角提出改进的方法是______.所发生反应的化学方程式是______.
(6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应方程式为:
2Na2S2O3+I2═Na2S4O6+2NaI?反应完成时,共用去Na2S2O3?20.0mL.则该漂白粉中Ca(ClO)2的质量分数为______.(保留至0.01%)
参考答案:(1)A部分用于制取Cl2,根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置,应选属于“固+液?△?.?气”型的b,故答案为:b;
(2)d装置的两个主要的玻璃器皿为圆底烧瓶和分液漏斗,故答案为:分液漏斗;圆底烧瓶;
(3)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(4)C装置中是氯气通入亚硫酸钠溶液中发生的反应,亚硫酸钠具有还原性被氯气氧化为硫酸钠,反应的两种方程式为:Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+;进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应,Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O;或HCO3ˉ+Cl2=HClO+CO2↑+Cl-,
故答案为:Cl2+H2O+SO32ˉ=SO42ˉ+2Clˉ+2H+;Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O;或HCO3ˉ+Cl2=HClO+CO2↑+Cl-;
(5)NaHCO3吸收Cl2的能力有限,在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:在D装置后增加一个尾气吸收装置,应将尾气通入NaOH溶液中;Cl2+2NaOH=NaCl+NaClO+H2O;
(5)关系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=14n(Na2S2O3)=20.0 mL×10-3 L?mL-1×0.1 mol?L-1×250ml25ml=0.005 mol,
Ca(ClO)2%=0.005mol×143g/mol2.0g×100%=35.75%,
故答案为:35.75%.
本题解析:
本题难度:一般
3、选择题 下列物质能由单质直接化合而成,但不能由单质和盐酸反应生成的是
A.FeCl2
B.CuCl2
C.AlCl3
D.NaCl
参考答案:B
本题解析:铁和氯气直接化合生成的是氯化铁,选项A不正确;金属铝和盐酸或氯气反应都是生成氯化铝,选项C不正确;同样钠和氯气或盐酸反应都是生成氯化钠、铜盐酸不反应,和氯气反应生成氯化铜,选项B正确,答案选B。
本题难度:一般
4、选择题 向KI溶液中加入AgNO3溶液,直到反应恰好完全为止,结果反应后溶液的质量恰好等于原KI溶液的质量,则该AgNO3溶液中溶质的质量分数为(? )
A.50.0%
B.48.8%
C.38.2%
D.72.3%
参考答案:D
本题解析:这是一道没有数据的计算题。根据题意可推知AgNO3溶液的质量等于生成AgI沉淀的质量。又AgNO3—AgI↓,则AgNO3溶液中溶质的质量分数为:
w(AgNO3)= ×100%=72.3%。
×100%=72.3%。
本题难度:简单
5、选择题 下列有关氯气的叙述正确的是
[? ]
A.氯气能与铁反应,故不能用铁罐存放液氯
B.液氯和氯水不是同一种物质,但是都含有氯元素
C.工业上用点燃氢气和氯气的混合气体的方法制取氯化氢
D.用氯气对生活用水进行消毒的原因是氯气本身能杀灭细菌
参考答案:B
本题解析:
本题难度:简单