1、实验题 某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为_________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: _______?_________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为?(请写出计算过程)
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl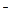 、OH
、OH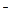 和SO
和SO
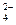 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO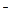 ;假设3:SO32-、ClO
;假设3:SO32-、ClO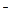 都存在。
都存在。
设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI
L-1KMnO4、淀粉-KI 溶液、紫色石蕊试液.
溶液、紫色石蕊试液.
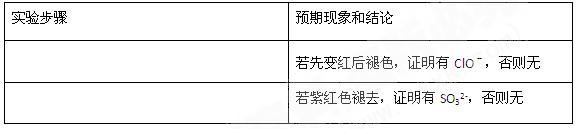
实验步骤
| 预期现象和结论
|
 步骤1:取少量吸收液于试管中,滴加3 moL 步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中.
| ?
|
步骤2:在A试管中滴加紫色石蕊试液
| ?
|
步骤3:在B试管中滴加0.01mol L-1KMnO4 L-1KMnO4
| ?
|
?
参考答案:(1)SO2?+? 2 NaOH="==?" Na2SO3?+? H2O?
(2)Na2SO3
(3)MnO2?+ 2Cl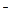 ? +4H+ ="==?" Cl2? +? Mn2+? +? 2H2O
? +4H+ ="==?" Cl2? +? Mn2+? +? 2H2O
(4)解:n(Cl2  )=14.2g/71g·mol
)=14.2g/71g·mol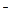 =0.2(mol)
=0.2(mol)
Cl2?+? H2?="==?" 2HCl
0.2mol? 0.4mol?(2分)
HCl? +? NaOH ="==?" NaCl?+? H2O
0.4mol? 0.4mol
C( NaOH)=" 0.4mol/0.5L=0.8mol/L?" (2分)
(5)②
本题解析:略
本题难度:简单
2、选择题 已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O、如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好、下列描述正确的是
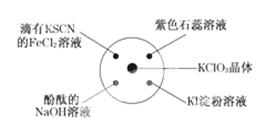
A.淀粉KI溶液中变蓝,说明Cl2具有氧化性
B.滴有酚酞的NaOH溶液褪色,说明Cl2具有酸性
C.石蕊溶液先变红后褪色,说明Cl2具有漂白性
D.滴有KSCN的FeCl2溶液变红,说明Cl2具有还原性
参考答案:A
本题解析:
解决本题学生要熟记相关反应方程式。
仔细读题不难看出隐含条件:有水
A:Cl2 + 2KI =" 2KCl" + I2生成物I2和淀粉作用显蓝。正确。
B:Cl2+2NaOH=NaCl+NaClO+H2O 发生反应而褪色。
C:Cl2 + H2O =" HCl" + HClO 生成了HClO具有漂白性。
D:Cl2 + 2Fe2+ = 2Cl- + 2Fe3+体现Cl2的强氧化性。
本题难度:一般
3、选择题 下列叙述正确的是()
A.如果加CCl4呈现紫色,证明原溶液中存在I-
B.凡能使湿润的碘化钾淀粉试纸变为蓝色的气体一定是Cl2
C.某溶液中加入BaCl2溶液,产生不溶于稀HNO3的白色沉淀,原溶液中一定含有Ag+
D.氢氟酸是弱酸,但会腐蚀玻璃
参考答案:D
本题解析:I-不溶于CCl4,只有转化成I2才可溶;能使湿润的KI-淀粉试纸变蓝的气体不一定是Cl2,还有O3、NO2、Br2(g)等;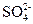 也符合C选项。
也符合C选项。
本题难度:简单
4、选择题 下列卤素化合物不可能存在的是(?)
A.NaBrO3
B.NaFO
C.HClO4
D.HClO
参考答案:B
本题解析:F无正价。
本题难度:简单
5、选择题 下列有关实验操作、发生的现象、解释或结论都正确的是( )
| ?选项 | ?实验操作 | 发生现象? | 解释或结论?
?A
?向NaCl和KI的混合溶液中,逐滴加入AgNO3溶液
?溶液中先产生白色沉淀,后产生黄色沉淀
?Ksp(AgCl)<Ksp(AgI)
?B
?用玻璃棒蘸取氯水点到蓝色石蕊试纸上
?试纸先变红后褪色
?氯水中含有H+和HClO
?C
?将铜片与芯片用导线连接后,插入稀硫酸中
?铜片上有气泡产生
?在锌的作用下,铜与硫酸反应产生氢气
?D
?向某溶液中加入过量盐酸
?产生能使澄清石灰水变浑浊的无色气体
?该溶液为Na2CO3
|
A.A
B.B
C.C
D.D
参考答案:A、向NaCl和Kl的混合溶液中,逐滴加入AgNO3溶液,但?Ksp(AgCl)>Ksp(Agl),所以溶液中先产生黄色沉淀,后产生白色沉淀,故A错误;
B、氯水中含有HCl和HClO,HCl能使蓝色石蕊试纸变红,HClO能使变红色褪去,故B正确;
C、铜-锌-稀硫酸原电池中,锌片上锌失电子变成阳离子进入溶液,发生氧化反应,铜片上氢离子得电子,发生还原反应,铜与硫酸不反应产生氢气,故C错误;
D、向某溶液中加入过量盐酸,产生能使澄清石灰水变浑浊的无色气体,则该溶液中含有碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸酸氢根离子中的一种或多种,阳离子无法确定,故D错误;
故选:B.
本题解析:
本题难度:一般