1、选择题 下列有关化学反应速率的说法正确的是( )
A.凡是能量达到活化能的分子发生的碰撞均为有效碰撞
B.增大反应物浓度能加快正反应的反应速率,降低逆反应的反应速率
C.温度升高使化学反应速率加快的主要原因是增加了反应物分子之间的碰撞次数
D.决定化学反应速率的根本因素是参加反应的各物质的性质
参考答案:A.能量达到活化能的分子为活化分子,当活化分子发生碰撞能发生化学反应,有新物质生成的碰撞为有效碰撞,故A错误;
B.增大反应物浓度,正逆反应速率都增大,故B错误;
C.温度升高使化学反应速率加快的主要原因是活化分子的百分数增加,增加了反应物分子之间的有效碰撞次数,故C错误;
D.影响反应速率的主要因素是物质的本身性质,如钠和冷水剧烈反应,但铁需要高温下才能与水蒸气反应,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是?
[? ]
A.加热?
B.加入硝酸钠固体
C.滴加少量CuSO4溶液?
D.不用铁片,改用铁屑
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列各组实验中,过氧化氢分解最快的是( )
| H2O2的浓度(质量分数) | 温度(℃) | 催化剂的使用
A
2
10
使用MnO2
B
4
10
不使用
C
6
30
使用MnO2
D
6
30
不使用
|
A.A
B.B
C.C
D.D
参考答案:浓度越大,温度越高,反应速率越快,使用催化剂加快反应.
故选C
本题解析:
本题难度:简单
4、选择题 本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡“一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
参考答案:从工业生产的实际出发,外界条件只影响化学反应速率的大小,不影响原料的转化率,但根据化学平衡理论,结合影响化学平衡移动的因素,可根据反应方程式的特点,可选择合适的温度、压强,促进平衡向正反应方向移动,从而使原料尽可能多地转化为产品,提高反应物的转化率,很明显C项错误.
故选C.
本题解析:
本题难度:一般
5、选择题 在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
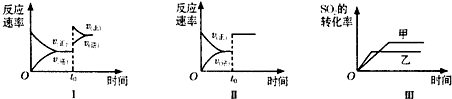
A.图I研究的是t0时刻增大O2的浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻增大压强后对反应速率的影响
C.图III研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
参考答案:A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅰ应是增大压强的原因,故A错误;
B.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B错误;
C.图III甲、乙两个平衡状态不同,而加入催化剂,平衡不发生移动,故C错误;
D.正反应放热,升高温度,反应速率增大,平衡向逆反应方向移动,SO3的转化率减小,故D正确.
故选D.
本题解析:
本题难度:简单