| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《影响化学反应速率的因素》高频考点巩固(2017年模拟版)(八)
参考答案:B 本题解析:A中升高温度反应速率加快。B中浓硫酸和铁在常温下发生钝化,得不到氢气。C中铁能置换出铜,从而构成原电池,加快反应速率。D中增大反应物的接触面积,加快反应速率,答案选B。 本题难度:一般 3、选择题 升高温度,下列数据不一定增大的是( ) 参考答案:A.升高温度,活化分子碰撞的几率增大,则化学反应速率一定增大,故A不选; 本题解析: 本题难度:简单 4、实验题 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反
要得出正确的实验结论,还需控制的实验条件是________。 (2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;应该测定的实验数据是____________________________。 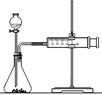 (3)在使用铁与稀硫酸反应制氢气时,实验室里选择粗铁比纯铁效果更好,原因是: 。 参考答案:(1)反应物本身的性质对反应速率的关系;(3分) 温度相同;(2分) 本题解析:比较金属性强弱可以用金属与酸反应的剧烈程度及置换出氢气的难易程度来比较。因为影响反应速率的外界因素很多,所以在比较金属和酸的剧烈程度及置换氢气的难易程度时,需要控制外界条件相同,因为硫酸的浓度是相同的,所以还应让溶液的温度相同。根据乙同学所用实验装置图可得出,该同学是想利用金属在相同的时间内置换出氢气的多少来比较其金属性强弱的,实验需要测量定时间内产生气体的体积(或产生一定体积的气体所需时间)。因为在常温下铁和浓硫酸发生钝化,所以不能选择浓硫酸。粗铁中含有杂质,在溶液中可以构成原电池加快反应速率。 本题难度:困难 5、选择题 在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是 |
参考答案:C
本题解析:
试题解析:增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,而升高温度和加入催化剂既能增大活化分子数,又能增大活化分子百分数,移去生成物,浓度降低,活化分子数目减小。
考点:外界条件对反应速率的影响
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《原电池原理.. | |