|
高考化学知识点归纳《化学平衡》高频试题强化练习(2017年最新版)(十)
2017-11-11 01:39:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 放热反应CO(g)+H2O(g)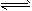 CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则 CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
[? ]
A.K2 和K1的单位均为mol/L
B.K2<K1
C.c2(CO)=c2(H2O)
D.c1(CO)>c2(CO)
参考答案:BC
本题解析:
本题难度:一般
2、选择题 在298K时,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是:( ) 2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是:( )
A.
B.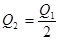
C.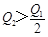
D.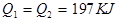
|
参考答案:A
本题解析:向密闭真空容器中通入2molSO2和1molO2与通入1molSO2和0.5molO2相比,后者相当于是前者扩大容器一倍的体积而达到的,扩大容器的体积,压强减小,平衡逆向移动,二氧化硫的转化率降低,所以后者放出的热量比前者的一半还少,所以 ,答案选A。 ,答案选A。
考点:考查对化学平衡移动的判断,反应放出热量的比较
本题难度:一般
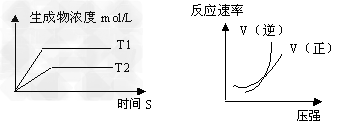
3、选择题 可逆反应aA(g)+bB(g) cC(g)+dD(g)?;△H?=?Q同时符合下列两图中各曲线的规律是 cC(g)+dD(g)?;△H?=?Q同时符合下列两图中各曲线的规律是
[? ]
A.a+b>c+d?T1>T2?Q>0?
B.a+b>c+d?T1<T2?Q<0
C.a+b<c+d?T1>T2?Q>0?
D.a+b>c+d?T1>T2?Q<0
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知反应2SO2(g)+O2(g) 2SO3(g)ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入 2SO3(g)ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入
SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
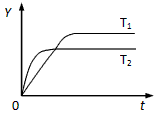
[? ]
A.O2的体积分数
B.混合气体的密度
C.密闭容器内的压强
D.SO2的转化率
参考答案:D
本题解析:
本题难度:一般
5、填空题 (20分)(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
2SO2(气)+ O2 (气)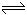 2SO3(气)△H<0。 2SO3(气)△H<0。
根据化学平衡原理来确定的条件或措施有 (填序号)。
A 为提高SO2的转化率,加入过量的空气
B 含SO2的炉气在进行氧化反应以前必须净化,其目的就是为了除尘、以防催化剂中毒
C 使用作V2O5催化剂
D.反应条件不使用很高温度
E.氧化反应在常压下进行
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系
如下图所示。根据图示回答下列问题:
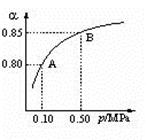
①将2 mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,体系的总压为0.10MpPa,该反应的平衡常数为 。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(3)若实验室在催化剂存在的条件下,向某密闭容器中充入1.6molSO2和0.8molO2,此时容器体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.50,SO2的转化率为α。
①达平衡时混合气体的体积为_________,α为_________;
②若保持温度和压强不变,平衡时再充入1 molSO3,则平衡时SO2体积分数为 ;
③若起始时充入x mol SO2、y molO2和z mol SO3,在,反应达平衡时,测得混合气体的体积为120 L,SO3体积分数仍为0.5。则x、 y应满足的关系式为 ,x、z应满足的关系式为 。
④在同样的温度下,若条件为恒温恒容(100L),在此容器中加入1.6molSO2和0.8molO2到达平衡时,SO2的转化率_______α(填“大于”、“小于”或“等于”)
(4)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后在加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为 。
参考答案:(20分,每空2分)(1)AD
(2)①800 ②=
(3) ①80L 60% ②1/3 ③x=2y,x+z=2.4 ④小于
(4)c(NH4+)>c(SO42-)> c(H+)> c(OH-)
本题解析:(1)A、为提高SO2的转化率,加入过量的空气,氧气浓度增大,平衡正向移动,二氧化硫的转化率增大,正确;B、含SO2的炉气在进行氧化反应以前必须净化,其目的就是为了除尘、以防催化剂中毒,是根据催化剂确定的,与化学平衡无关,错误;C、使用催化剂,不影响化学平衡的移动,与反应速率有关,与化学平衡无关,错误;D、反应条件不使用很高温度,是因为该反应是放热反应,温度不高,有利于正反应正向进行,是根据化学平衡确定的,正确;E、氧化反应在常压下进行,是因为此压强下的二氧化硫的转化率已经很高,没必要再增大压强,不是由化学平衡确定的,错误,答案选AD;
(2)①体系总压强是0.10MpPa时二氧化硫的转化率是80%,则参加反应的二氧化硫为2mol×80%=1.6mol,则:
2SO2(气)+ O2 (气)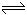 2SO3(气) 2SO3(气)
开始(mol): 2 1 0
变化(mol): 1.6 0.8 1.6
平衡(mol): 0.4 0.2 1.6
所以平衡时浓度:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,故平衡常数k=0.162/0.042×0.02=800;
②该图像是某温度下的图像,化学平衡常数只与温度有关,温度不变,平衡常数不变,所以平衡状态由A变到B时,平衡常数K(A)= K(B);
(3)①平衡时三氧化硫的体积分数也是物质的量分数,设消耗氧气的物质的量是xmol,则
2SO2(气)+ O2 (气)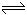 2SO3(气) 2SO3(气)
开始(mol): 1.6 0.8 0
变化(mol): 2x x 2x
平衡(mol): 1.6-2x 0.8-x 2x
所以2x/(1.6-2x+0.8-x+2x)=0.5,解得x=0.48,则平衡时气体的物质的量是反应前的(1.6+0.8-0.48)/(1.6+0.8)=0.8,所以平衡时混合气体的体积也是原来的0.8倍,即100L×0.8=80L;二氧化硫的转化率α为2x/1.6×100%=60%;
②保持温度和压强不变,再充入1 molSO3,转化为二氧化硫、氧气的物质的量之比仍是2:1,所以再达平衡时与原平衡是等效的,二氧化硫的体积分数与原平衡相同,都是(1.6-2x)/(1.6-2x+0.8-x+2x)=1/3;
③SO3体积分数仍为0.5,所以与原平衡是等效平衡,因为原平衡时二氧化硫、氧气得物质的量之比是2:1,且SO3转化为二氧化硫、氧气的物质的量之比仍是2:1,所以x:y=2:1,即x=2y;将zmol的SO3转化为二氧化硫的物质的量是zmol,平衡时的体积是120L,是原平衡时体积80L的1.5倍,则二氧化硫、氧气得起始物质的量相当于是1.6mol、0.8mol的1.5倍,所以x+z=1.6×1.5=2.4;
④若条件为恒温恒容(100L),在此容器中加入1.6molSO2和0.8molO2到达平衡时,与恒温恒压比压强减小,平衡逆向移动,二氧化硫的转化率降低,所以SO2的转化率小于α;
(4)硫酸铵溶液由于铵根离子的水解使溶液呈酸性,所以溶液中离子的浓度大小顺序是c(NH4+)>c(SO42-)> c(H+)> c(OH-)。
考点:考查化学平衡的移动、平衡常数的计算,等效平衡的判断与应用,离子浓度的比较
本题难度:一般
|