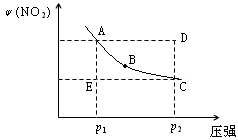
1、选择题 对于反应N2O4(g) 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2) 随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
[? ]
A.A、C两点的正反应速率的关系为A>C
B.A、B、C、D、E各状态中,v(正)<v(逆)
C.维持p1不变,E→A所需时间为x;维持p2不变, D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1
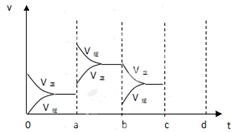
2、填空题 (10分) (1)下图左表示在密闭容器中反应:2SO2+O2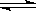 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;
b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
(2)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知:(a) N2 (g) + 2O2 (g) = 2NO2 (g) △H =" +" 67.7kJ/mol
(b) N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
(c) 1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
(d) H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
①肼和二氧化氮反应的热化学方程式为 ;
②有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
3、选择题 如下图所示:等温时,a、b容器开始体积相等,各充入等量的SO3(g),则平衡时SO3的转化率大小关系是 ( )
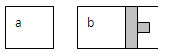
A.a>b
B.a<b
C.a=b
D.无法确定