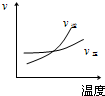
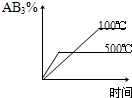
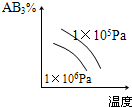
1、选择题 对于可逆反应2AB3(g)?A2(g)+3B2(g),正反应吸热,下列图象正确的是( )
A.
B.
C.
D.
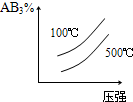
参考答案:BD
本题解析:
本题难度:一般
2、选择题 对于mA(g)+nB(g)?pC(g)+qD(g)的平衡体系,当升高温度时体系的平均相对分子质量减少.则下列说法正确的是( )
A.m+n>p+q,正反应是放热反应
B.m+n>p+q,正反应是吸热反应
C.m+n<p+q,逆反应是放热反应
D.m+n<p+q,逆反应是吸热反应
参考答案:A.如果该反应是一个反应前后气体体积减小的化学反应,升高温度要使反应体系的平均分子质量减小,则平衡向逆反应方向移动,则正反应是放热反应,逆反应是吸热反应,故A正确;
B.如果该反应是一个反应前后气体体积减小的化学反应,升高温度要使反应体系的平均分子质量减小,则平衡向逆反应方向移动,则正反应是放热反应,逆反应是吸热反应,故B错误;
C.如果该反应是一个反应前后气体体积增大的化学反应,升高温度要使反应体系的平均分子质量减小,则平衡向正反应方向移动,则正反应是吸热反应,逆反应是放热反应,故C正确;
D.如果该反应是一个反应前后气体体积增大的化学反应,升高温度要使反应体系的平均分子质量减小,则平衡向正反应方向移动,则正反应是吸热反应,逆反应是放热反应,故D错误;
故选AC.
本题解析:
本题难度:一般
3、填空题 (12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K=?,SO2的平衡转化率=?。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。则该条件下反应的平衡常数K=?,SO2的平衡转化率=?。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有?(填字母)
A.升高温度
B.降低温度
C.增大压强
D.减小压强 (E)加入催化剂 (G)移出氧气