| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《离子共存》试题特训(2017年最新版)(四)
(2)将滤液的pH调至酸性除去的离子是________,发生反应的离子方程式为________。 (3)若用惰性电极电解200mL1.5mol/L食盐水,当电解2min时,两极共收集到448mL气体(标准状况下)。假设电解前后溶液的体积不变,则电解后该溶液的pH为______。 (4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是___________。 (5)纯碱在生产生活中有广泛的应用。 ①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)_____________。 ②常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。则反应前的溶液中与反应后的滤液中水电离出的 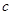 (OH-)的比值是_________。 (OH-)的比值是_________。参考答案:(1) adbc或dabc (2分)?过滤和蒸发结晶 (2分) 本题解析:(1)除杂过程中,有时为能将杂质全部除去,所用除杂试剂往往稍加过量,但过量的试剂最终要能被其他试剂所除尽。必须了解各个实验步骤的目的,才能分清操作顺序。加入过量的NaOH溶液的目的是除去Mg2+,加入过量的BaCl2溶液是为了除去SO42-,加入过量的Na2CO3溶液是为了除去Ca2+及多余的Ba2+,然后进行过滤,除去Mg(OH)2、BaSO4、CaCO3、BaCO3等难溶物,然后加适量的盐酸,除去多余的Na2CO3和调节溶液的pH。综上所述,正确的实验操作顺序为adbc或dabc;还缺少的操作步骤是过滤和蒸发结晶。 本题难度:困难 4、选择题 室温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是 参考答案:B 本题解析:解:由水电离产生的c(H+)和?c(OH-)满足c(H+)?c(OH-)=10-24,c水(H+)=10-12,为酸或碱溶液。A、酸溶液中不能大量存在AlO2-,故A错误;B、无论酸或碱溶液中该组离子之间不反应,能大量共存,故B正确;C、酸溶液中Fe2+、H+、NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,不能大量共存,故C错误;D、碱溶液中不能大量存在NH4+,故D错误。 本题难度:一般 5、填空题 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-. 现取三份各100mL溶液进行如下实验: |
参考答案:(1)否 ; Ag2CO3 Ag2SO4都是沉淀 (答对其中1个算对)
(2)NH4+ 0.8 mol/L
(3)BaCO3 BaSO4 ; n (CO32-)="0.04" mol n(SO42-)="0.02" mol
(4)A (3分)
本题解析:根据第二份信息确定溶液中含有NH4+,且量为0.08mol;根据第三份信息得出沉淀为硫酸钡和碳酸钡,量分别为4.66÷233=0.02mol,(12.54-4.66)÷197=0.04mol,故溶液中含有CO32-、SO42-且量分别为0.04mol和0.02mol;(1)硫酸银和碳酸银等均为沉淀,故不能只根据加入AgNO3溶液有沉淀产生得出含有Cl- 结论;(4)根据溶液中含有CO32-、SO42-判断溶液中不含有Ca2+、Ba2+;根据电荷守恒,得出溶液中一定含有阳离子即含有K+(溶液中CO32-、SO42-所带负电荷数大于NH4+所带正电荷数),可能含有Cl- ,若不含时n(K+)=2n(CO32-)+2n(SO42-)-n(NH4+)[电荷守恒]=0.04mol,若含有Cl- ,则n(K+)>0.04mol,故答案为A。
考点:考查定性和定量检验溶液中的离子有关问题。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《原电池原理.. | |