1、选择题 用1 L 1.0 mol·L-1 NaOH溶液吸收0.8 mol CO2,所得溶液中的CO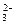 和HCO
和HCO 的浓度之比约是
的浓度之比约是
A.1∶3
B.1∶2
C.2∶3
D.3∶2
参考答案:A
本题解析:当两反应物的物质的量之比为1∶1时,产物为NaHCO3;为2∶1时,产物为Na2CO3;处于两比值之间时为两产物的混合物。设Na2CO3的物质的量为x,NaHCO3的物质的量为y,则:2x+y=1 L×1.0 mol·L-1?x+y=0.8 mol解得x∶y=1∶3
本题难度:简单
2、选择题 某同学用沉淀量测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。
①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀
②检验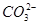 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
③用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是实验结果的准确度较高
④用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是碳酸根离子能完全转化为沉淀。
其中正确的是
A.①③
B.②③
C.②④
D.①④
参考答案:B
本题解析:该测定方法应该使Na2CO3和NaOH混合物中的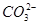 转化为碳酸盐沉淀,然后求得混合物中NaOH的质量,不能选用MgCl2溶液作沉淀剂,因为碳酸钠水解产生OH-,也可以与MgCl2反应,①错;检验
转化为碳酸盐沉淀,然后求得混合物中NaOH的质量,不能选用MgCl2溶液作沉淀剂,因为碳酸钠水解产生OH-,也可以与MgCl2反应,①错;检验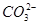 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液,观察是否继续生成沉淀,②正确;碳酸钡的溶度积比碳酸钙的溶度积小,③正确;碳酸钡在水溶液中也存在溶解平衡,故碳酸根离子不能完全转化为沉淀,④错。
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液,观察是否继续生成沉淀,②正确;碳酸钡的溶度积比碳酸钙的溶度积小,③正确;碳酸钡在水溶液中也存在溶解平衡,故碳酸根离子不能完全转化为沉淀,④错。
本题难度:一般
3、选择题 下列有关Na2CO3 和NaHCO3性质的比较中,正确的是
和NaHCO3性质的比较中,正确的是
A.常温时在水中的溶解度:Na2CO3 < NaHCO3
B.热稳定性:Na2CO3 < NaHCO3
C.等质量的Na2CO3和 NaHCO3与足量稀盐酸反应,产生CO2的量: Na2CO3 < NaHCO3
D.等物质的量的Na2CO3和 NaHCO3与足量稀盐酸反应,产生CO2的量: Na2CO3 < NaHCO3
参考答案:C
本题解析:略
本题难度:一般
4、选择题 钠铝合金(常温液态)可作核反应堆的载热介质,下列说法错误的是
A.该合金的熔点低于金属钠的熔点
B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Na)≥n(Al)
C.若将钠铝合金投入FeCl3溶液有Fe(OH)3沉淀生成
D.等质量的钠铝合金中铝含量越大,与足量盐酸反应时放出的氢气越少
参考答案:D
本题解析:A、合金的熔点比组成金属要低,正确;B、根据反应关系式:2Al——2NaOH,B正确;C、金属钠首先与水反应生成氢氧化钠,再与氯化铁反应生成氢氧化铁沉淀,正确;D、根据关系式:2Na——H2?2Al——3H2,可得,相同质量时铝生成氢气多,所以铝含量越大,与足量盐酸反应时放出的氢气越多。
本题难度:一般
5、选择题 下列俗称表示同一物质的是(?)
A.苏打、小苏打
B.胆矾、绿矾
C.火碱、烧碱
D.纯碱、烧碱
参考答案:C
本题解析:本题主要考查中学教材中出现的常见物质的俗名。可通过分类比较,熟记有关物质的俗名,如大苏打、苏打、小苏打分别为硫代硫酸钠、碳酸钠、碳酸氢钠;含有结晶水的某些硫酸盐统称为矾,CuSO4·5H2O称为胆矾,FeSO4·7H2O称为绿矾等。纯碱是Na2CO3,火碱、烧碱都是指NaOH。
本题难度:一般