1、填空题 (6分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及其物质的量浓度,进行以下实验:
①量取25.00ml甲溶液,向其中缓慢滴入乙溶液15.00ml,共收集到224ml(标准状况)气体。②量取15.00ml乙溶液,向其中缓慢滴入甲溶液25.00ml,共收集到112ml(标准状况)气体。
⑴判断:甲是?溶液,其物质的量浓度为?mol/L。
乙是??溶液,其物质的量浓度为?mol/L。
⑵实验②中所发生反应的离子方程式为?。
参考答案:(6分)
(1)HCl 0.8 mol·L-1? Na2CO3 1mol·L-1
(2)CO32-+ H+ ="=" HCO3—? H++HCO3—=CO2↑+H2O
本题解析:略
本题难度:简单
2、选择题 关于Na2CO3和NaHCO3,下列说法中正确的是(?)
A.Na2CO3比NaHCO3易溶于水
B.NaHCO3比Na2CO3稳定
C.石灰水能与NaHCO3反应,但不与Na2CO3反应
D.等质量的 Na2 CO3和NaHCO3与盐酸反应,消耗HCl的质量比为42:53,
参考答案:A
本题解析:碳酸氢钠稳定性差,加热易分解生成碳酸钠;石灰水与碳酸钠也反应生成碳酸钙沉淀;等质量的 Na2 CO3和NaHCO3与盐酸反应,消耗HCl的质量比为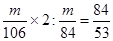 ,所以正确的答案选A。
,所以正确的答案选A。
点评:该题是中等难度的试题,试题基础性强,注重能力的培养的解题方法指导,有助于培养学生的创新思维能力。该题的关键是熟练记住碳酸钠和碳酸氢钠性质,包括物理性质和化学性质,然后灵活运用即可。
本题难度:一般
3、选择题 在一密闭容器中有HCHO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再
将燃烧后的气体用Na2O2充分吸收,Na2O2增重8.5g,则原混合气体中O2的物质的量是(?)
A.0.50mol
B.0.25 mol
C.0.27 mol
D.0.52 mol
参考答案:B
本题解析:凡是符合(CO)x(H2)y形式的物质,电火花引燃完全燃烧,燃烧产物用Na2O2
充分吸收,Na2O2增重为该物质的质量,CH2O、H2、O2共16.5g,反应后Na2O2增重8.5g,
所以8.5g为CH2O和H2质量,O2质量为8g,混合气体中O2的物质的量为
8g/32g·mol-1=0.25mol。
本题难度:简单
4、选择题 美国“海狼”潜艇上的核反应堆内使用了液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是?( )。
A.原子半径:Na>Al
B.若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na)
C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小
D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成
参考答案:C
本题解析:本题考查钠、铝及其化合物的性质。元素周期表中Na、Al位于同周期,Na的原子序数小于Al,故原子半径:Na>Al,A项正确;Na与H2O反应生成NaOH和H2,Al与NaOH反应生成NaAlO2和H2,关系式为Na~NaOH~Al,得到无色溶液,说明Na、Al全部溶解,n(Al)≤n(Na),B项正确;失去1 mol电子(产生 mol H2),消耗Na为23 g,而消耗 Al为9 g,故相同质量的Na、Al,后者放出氢气较多,在合金中Al的质量分数越高,放出的氢气就越多,C项错误。
本题难度:一般
5、选择题 下列物质中不与NaOH溶液反应的是
①酚酞?②Fe?③SiO2?④蛋白质?⑤Cl2?⑥NaHCO3?⑦NO2?⑧CH3COOC2H5
A.①②④
B.①②④⑦⑧
C.②④
D.②
参考答案:D
本题解析:略
本题难度:一般